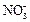Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванокоррозия вызывается многими причинами.Содержание книги
Поиск на нашем сайте
1. Основная причина возникновения гальванокоррозии – тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита. Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент. Например, спай алюминия с медью. По соотношению потенциалов алюминий является анодом, медь – катодом. Рассмотрим данную гальванопару в кислой среде:
Таким образом, будет растворяться (разрушаться) анод, в данном случае алюминий. 2.Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу – чугунам и сталям. Техническое железо состоит в основном из кристаллов железа и участков цементита (Fe3C). Кристаллы железа играют роль микроанодов, участки цементита – микрокатодов. Рассмотрим данную систему в условиях контакта с воздухом, содержащим влагу (О2+2Н2О): (–): Fe0 – 2ē → Fe+2, (+): O2 + H2O + 4ē → 4OH–. 3. Следующей распространенной причиной возникновения гальванокоррозии является аэрация – неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла. Например, вбитый во влажное дерево гвоздь. Та часть гвоздя, к которой доступ кислорода свободен, будет являться катодом. Часть гвоздя, находящаяся в дереве, будет анодом, в результате пойдут реакции: (–): Fe0 – 2ē → Fe+2, (+): O2 + H2O + 4ē → 4OH-. Защита металлов от коррозии Существует много способов борьбы с коррозией. основными способами защиты являются: · электронная защита (протекторная защита и электрозащита); · использование защитных покрытий (металлических, неметаллических и др.); · легирование металлов. К электрозащите относятся способы, при которых к защищаемому изделию направляется поток электронов, как, например, при катодной защите или протекторной защите. катодная защита заключается вследующем: к катоду, отрицательному полюсу внешнего источника постоянного тока, присоединяют защищаемый металл, к аноду – лом (отходы металла). Пока поступает ток от внешнего источника, анод разрушается, а катод остается целым. Недостатком этого метода является расход электроэнергии. Суть протекторной защиты: два металла – защищаемый и протектор – приводятся в тесный контакт посредством склеивания или приклепывания. Металл протектора подбирается так, чтобы он являлся анодом (имел меньший электродный потенциал) по отношению к защищаемому изделию. В первую очередь разрушается анод, защищаемое изделие сохраняется. Данный вид защиты относится к электрозащите, так как в системе возникает направленный поток электронов. Электрозащита применяется в тех случаях, когда объем окружающей агрессивной среды очень велик. Электрозащита применяется на морских судах (подводные части), для защиты всех подводных и подземных сооружений. В качестве первых защитных металлических покрытий использовались цинк и олово. Покрытие цинком называют цинкованием. Покрытие оловом – лужением. По соотношению потенциалов защищаемого металла и покрытия все защитные покрытия делятся: · на катодные покрытия – потенциал металла покрытия больше потенциала основного металла; · анодные покрытия – потенциал металла покрытия меньше потенциала основного металла. К защитным неметаллическим покрытиям относятся краски, лаки, эмали, полимеры, а также фосфотирование и оксидирование (воронение) стали. Легирование – также эффективный метод повышения стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, вольфрам и др. Обучающие задачи Задача 1. Возможна ли коррозия сплава, состоящего из никеля и меди: а) при рН = 4; б) при рН = 7? Составьте схему микрогальванических элементов, возникающих в процессе коррозии. Составьте уравнения анодного и катодного процессов. Решение. Как любой окислительно-восстановительный процесс, коррозия возможна, если потенциал окислителя больше потенциала восстановителя (Е ок > Е восст). Отсюда следует, что в первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом является никель ( а) Определим возможность коррозии при рН = 4. Потенциал кислородного электрода при 298 К описывается уравнением
Потенциал водородного электрода описывается уравнением
так как Схема микрогальванического элемента: Ni │O2, H+ │Cu. Никель будет слева, а медь справа, следовательно, протекают процессы: (–): Ni – 2e → Ni2+, (+): O2 + 4e + 4H+ → 2H2O. б) Определим возможность коррозии при рН = 7. Потенциал кислородного электрода при 298 К описывается уравнением:
Потенциал водородного электрода рассчитывается на основании уравнения:
так как Схема микрогальванического элемента: Ni │O2, H2О │Cu. Никель будет анодом, а медь – катодом. Протекают процессы: (–): Ni – 2e → Ni2+, (+): O2 + 4e + 2H2О → 4ОН–. Задача 2. Возможна ли коррозия сплава, состоящего из мелкодисперсных кристаллов висмута и свинца: а) в аэрируемой воде; б) в изолированном от воздуха сосуде с водой? Для среды, в которой коррозия возможна, составьте схему микрогальванических элементов, возникающих в процессе коррозии. Составьте уравнения анодного и катодного процессов и суммарное уравнение процесса коррозии. Решение. Как любой окислительно-восстановительный процесс, коррозия возможна, если потенциал окислителя больше потенциала восстановителя (Е ок > Е восст). Отсюда следует, что в первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом в данном примере является свинец ( а) В аэрируемой воде из двух возможных окислителей – иона водорода воды Н+ и растворенного в воде кислорода О2 – более сильным окислителем является кислород, так как его потенциал больше (в нейтральной среде (–): Pb – 2e → Pb2+, (+): O2 + 4e + 2H2О → 4ОН–. Продуктом коррозии будет являться гидроксид свинца Pb(OH)2. б) В отсутствие кислорода единственным окислителем могли бы быть ионы водорода из воды. Но поскольку Е ок = –0,41 В < Е восст = Задача 3. Подберите катодное покрытие для сплава, состоящего из кобальта и свинца, при рН = 12. Напишите уравнения анодного и катодного процессов: а) без нарушения целостности покрытия; б) при нарушении целостности покрытия. Решение. Катодное покрытие – это металл у которого потенциал больше потенциала изделия. Изделие представляет собой сплав, состоящий из кобальта и свинца ( а) Если покрытие не нарушено, то с окружающей средой контактирует только покрытие, следовательно, разрушаться будет само покрытие. Протекают процессы: анод: Pd – 2e → Pd2+, катод: O2 + 4e + 2H2О → 4ОН–. б) Если нарушить целостность покрытия, то с окружающей средой контактируют и покрытие, и само изделие. В первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом в данном примере является кобальт: ( Протекают процессы: анод: Со – 2e → Со2+, катод: O2 + 4e + 2H2О → 4ОН–. Задача 4. Напишите уравнения электродных реакций при электрозащите сплава Cd – Cu при рН = 7. Решение. В основе электрозащиты лежит процесс электролиза. Суть электрозащиты сводится к следующему: к катоду, отрицательному полюсу внешнего источника постоянного тока, присоединяют защищаемый металл. Так как среда нейтральная, то в качестве электролита можно взять раствор NaCl:
 
К(–): 2H2O + 2e– ® H2 + 2OH–, A(+): 2Cl– – 2e– ® Cl2. Вопросы для самоконтроля 1. Что называют коррозией металлов? 2. Какие виды коррозии вы знаете? 3. В чем отличие электрохимической коррозии от химической? 4. Чем вызвана электрохимическая неоднородность поверхности металла? 5. Каковы причины возникновения коррозионных микрогальванических элементов? 6. Каким образом можно определить возможность протекания коррозии с выделением водорода и поглощением кислорода? 7. Основные способы борьбы с коррозией. 8. Если цинк покрыть медью, какое это будет покрытие: анодное или катодное? 9. В чем сущность электрозащиты? 10. Что такое легирование? 9.3.4. Домашнее задание № 11 Задание 1. Для сплава (см. свой вариант в табл. 28, задание 1) определите возможность коррозии при pH = 4 и 8, запишите коррозионные гальванические элементы и уравнения электродных реакций. Задание 2. Предложите для данного сплава катодное покрытие (четные варианты) и анодное покрытие (нечетные варианты). Обозначьте коррозионный гальванический элемент покрытие–сплав в среде с рН = 12. Напишите уравнения электродных реакций: а) при целостности покрытия; б) при нарушении целостности покрытия. Задание 3. Напишите уравнения электродных реакций при электрозащите сплава в среде с рН (см. свой вариант в табл. 28, задание 3). Таблица 28
Лабораторная работа № 12 Опыт 1. Электрохимическая неоднородность стали Выполнение опыта. Вследствие электрохимической неоднородности стали и наличия окислителя (кислород из воздуха) у ее поверхности образуются коррозионные микроэлементы. В процессе их работы осуществляется анодное растворение железа. А. Качественной реакцией на наличие в растворе ионов железа Fe2+ является взаимодействие исследуемого раствора с раствором K3[Fe(CN)6] с образованием турнбулевой сини (Fe3[Fe(CN)6]2). В пробирку наберите 0,5 мл воды и добавьте 1 – 2 кристалла FeSO4, потрясите пробирку, чтобы растворить соль, затем прибавьте несколько капель раствора K3[Fe(CN)6]. Задание. Напишите молекулярное и ионно-молекулярное уравнения образования осадка турнбулевой сини (Fe3[Fe(CN)6]2). Отметьте, что это качественная реакция на наличие в растворе ионов железа Fe2+. Б. Для проведения опыта зачистите стальную пластинку наждачной бумагой, промойте проточной водой и высушите фильтровальной бумагой. Затем положите на пластинку бумажный фильтр, смоченный ферроксилиндикатором (5 капель NaCl + 3 капли K3[Fe(CN)6] + 2 капли фенолфталеина). Через 2 – 3 мин опишите изменение цвета фильтровальной бумаги, форму и распределение пятен. Задание. Запишите электродные процессы, в выводе объясните появление разной окраски пятен в центре и по краям капли. Опыт 2. Анодные и катодные защитные покрытия Выполнение опыта. В две пробирки налейте (по 1/2 объема) воды и добавьте по 1 – 2 мл H2SO4 и по 2 – 4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите образец оцинкованного железа, а в другую – луженого с предварительно сделанными на их поверхности глубокими царапинами. Дайте постоять 5 минут. Что наблюдаете? Задание. Запишите уравнения анодных и катодных процессов и приведите схемы работы коррозионных элементов. В выводе объясните, в случае какого покрытия корродирует железо и почему, а также, какое покрытие является более эффективным. Опыт 3. Протекторная защита Выполнение опыта. В две пробирки налейте (по 1/2 объема) 0,4М уксусной кислоты и по 2 – 4 капли KI. В одну пробирку поместите cвинцовую пластинку, в другую – такую же полоску свинца, но в контакте с цинком (гальванопару). Наблюдайте, в какой пробирке быстрее появится желтое окрашивание за счет образования осадка PbI2 (качественная реакция на ионы свинца Pb2+). Задание. Напишите уравнения анодных и катодных процессов и приведите схемы работы коррозионных элементов в случае гальванопары и чистого свинца. Уравнение качественной реакции на ионы Pb2+. В выводе сформулируйте суть электрозащиты. Опыт 4. Электрозащита металла Выполнение опыта. В два стакана налейте (1/2 объема) 0,5 н раствор NаCl и добавьте по 3 – 5 капель K3[Fe(CN)6]. В один стакан поместите зачищенный и промытый железный стержень; в другой – такой же железный стержень, закрепленный в панельке с угольным стержнем. Железный электрод соедините с отрицательным полюсом внешнего источника постоянного тока, а угольный – с положительным. Включите ток на 2 мин. Объясните результаты наблюдений. Задание. Приведите схему электролиза раствора хлорида натрия с угольным анодом, а также схему гальванического элемента, образующегося за счет неоднородности поверхности железа, электродные процессы и реакции в растворе (в случае, когда железный стержень не подключается к отрицательному полюсу). В выводе сформулируйте суть электрозащиты и ее надежность.
СПИСОК ЛИТЕРАТУРЫ Основная 1. Коровин Н.В. Общая химия: учебник для вузов. – М.: Высшая школа, 2005. 2. Коровин Н.В., Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии. – М.: Высш. шк., 2001. 3. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. 4. Иванова М.А., Кононова М.А. Химический демонстрационный эксперимент. – М.: Высшая школа, 1969. 5. Романцев Л.М. и др. Сборник задач и упражнений по общей химии. – М.: Высшая школа, 1991. Дополнительная 1. Электронный учебник «Открытая химия 2.6». ООО «Физикон», 2005. 2. Гуров А.А., Бадаев Ф.З., Овчаренко Л.П. Химия. – М.: МГТУ им. Баумана, 2004. 3. Карапетьянц М.Х. Общая и неорганическая химия: учебник для ву- 4. Угай Я.А. Общая и неорганическая химия: учебник для вузов по напр. и спец. «Химия». – М.: Высшая школа, 1997. 5. Барон Н.М. Краткий справочник физико-химических величин/ Н.М. Барон, А.М. Пономарева, А.А. Равдель, З.Н. Тимофеева. – СПб.: Специальная литература, 1999. 6. Химическая энциклопедия. в 5 т./Под ред. И.Л. Кнунянца и др. – М.: Большая Российская энцикл., 1988 – 2002. 7. Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. – М.: Химия, 1988. 8. Фримантл М. Химия в действии. В 2 ч. – М.: Мир, 1998.
Приложения Приложение 1 Цели учебной дисциплины
Приложение 2 Теоретические вопросы курса
Приложение 3 Стандартные энтальпии образования D f H0298
Окончание табл. П3
Приложение 4 Термодинамические характеристики некоторых ионов
Приложение 5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.79.214 (0.01 с.) |




 =
=  = +0,34 B).
= +0,34 B). = 1,23 – 0,059 ·рН = 1,23 – 0,059·4 = 0,994 В;
= 1,23 – 0,059 ·рН = 1,23 – 0,059·4 = 0,994 В; = – 0,0059 · рН = – 0,059·4 = – 0,236 В,
= – 0,0059 · рН = – 0,059·4 = – 0,236 В, = –0,13 B <
= –0,13 B <  = +0,22 B).
= +0,22 B). = –0,28 B <
= –0,28 B <  = –0,13 B), следовательно, электродный потенциал покрытия должен быть больше потенциала свинца. Например, в качестве катодного покрытияможно взять палладий
= –0,13 B), следовательно, электродный потенциал покрытия должен быть больше потенциала свинца. Например, в качестве катодного покрытияможно взять палладий  = +0,99 В.
= +0,99 В.