
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические методы получения гидрофобных золей
Эти методы основываются на реакциях обмена, гидролиза, окисления – восстановления, а также применения пептизации. Метод ионного обмена мы рассмотрели выше в разделе «строение коллоидной частицы». Рассмотрим образование гидрофобного золя на основе ОВР: 2H2S + O2 → 2S + 2H2O. Строение мицеллы с учетом того, что сероводородная кислота, являясь слабым электролитом, диссоциирует только по первой ступени: { m [S] × n HS– × (n – x)H +} х –× x H+. Метод пептизации Пептизация – это процесс перевода свежеприготовленного осадка в коллоидно-дисперсное состояние. Пептизация бывает двух видов: непосредственная и посредственная. Непосредственной называется такая пептизация, при которой осадок и пептизатор имеют общий ион. Осадок CuS можно пептизировать с помощью ионов меди или серы (Cu2+; S2–). Если пептизатор Na2S, то: { m [CuS] × n S2–×2(n–x)Na+}2 x –×2 x Na+. Посредственной называется такая пептизация, при которой пептизатор образуется в ходе реакции образования золя. Например, если к свежеприготовленному осадку добавить небольшое количество HCl: Fe(OH)3 ↓+ HCl → Fe(OH)2Cl + H2O Fe(OH)2Cl → FeOCl + H2O FeOCl → FeO+ + Cl– { m [Fe(OH)3] × n FeO+ ×(n – x) Cl–} x +× x Cl– Разрушение гидрофобных золей Разрушения гидрофобных золей можно достигнуть добавлением к раствору индифферентного электролита (избирательно не адсорбирующегося на поверхности агрегата). Разрушающими будут являться те ионы электролита, которые имеют одинаковый заряд с зарядом диффузионного слоя или противоположный заряд с зарядом гранулы. Согласно правилу Шульце–Гарди: Коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона-коагулянта (правило значимости). В рядах: Na+ Ca2+ Al3+ и Cl- SO42– PO43+
Разрушающее действие постороннего электролита заключается в том, что однозарядный ион вытесняет ПИ диффузионного слоя в адсорбционный слой, следовательно, уменьшается заряд диффузного слоя и уменьшается заряд гранулы. В итоге уменьшается ζ-потенциал и мицеллы начинают терять свою защиту и слипаются. Когда слипание частиц достигает такого предела, что становится заметным помутнение раствора, соответствующая этому состоянию концентрация электролита носит название порог коагуляции (Сп).
Состояние, при котором ζ-потенциал становится равным нулю, т.е. гранула становится электронейтральной, называется изоэлектрическим состоянием. В изоэлектрическом состоянии коагуляция ускоряется и золь разрушается. Обучающие задачи Задача 1. Определите заряд гранулы и запишите строение мицеллы для уравнения AlCl3 + 3NaOH → Al(OH)3 + 3NaCl, в котором: а) избытком является AlCl3; б) NaOH. Решение: а) агрегат Al(OH)3 в случае избытка AlCl3 будет адсорбировать на своей поверхности ионы, способные достроить его кристаллическую решетку (правило Панета–Фаянса). такими ионами будут ионы Al3+, они же будут ПОИ и будут определять заряд гранулы. таким образом, гранула будет иметь положительный заряд. Строение мицеллы { m [ Al(OH)3 ] n Al3+ 3(n – x)Cl–}3 x + 3 x Cl–; б) агрегат Al(OH)3 в случае избытка NaOH будет адсорбировать на своей поверхности ионы, способные достроить его кристаллическую решетку. такими ионами будут ионы ОН–. таким образом, гранула будет иметь отрицательный заряд. Строение мицеллы { m [ Al(OH)3 ] n OH– (n – x)Na+}– х х Na+. Задача 2. Определите, добавление какого из перечисленных электролитов NaCl, Na2SO4, CaCl2, AlCl3, K[Fe(CN)6] быстрее всего приведет к разрушению золя { m [BaSO4]∙ n SO42– ∙2(n – x)Na+}2 x– 2 x Na+. Решение. Так как гранула заряжена отрицательно, то ион электролита, вызывающий коагуляцию, должен быть заряжен положительно. Из положительно заряженных ионов электролитов NaCl, Na2SO4, CaCl2, AlCl3, K[Fe(CN)6] находим тот, у которого заряд будет выше (Na+, K+, Ca2+, Al3+). им является Al3+. Таким образом, электролит AlCl3 имеет наименьший порог коагуляции и быстрее всего приведет к разрушению данного золя. Вопросы для самоконтроля 1. Каково строение мицеллы? Что такое гранула, ПОИ, ПИ? 2. Чем определяются j- и z-потенциалы? 3. Какие коллоидные системы называют золями? 4. Основные методы получения гидрофобных золей. 5. Основные способы разрушения гидрофобных золей. 6. Что такое порог коагуляции? 8.4. Домашнее задание № 8 Задание 1. Для уравнения реакции (см. свой вариант в табл. 21) запишите строение мицеллы, гранула которой будет двигаться к катоду (четные варианты) или к аноду (нечетные варианты), укажите агрегат, ядро, адсорбционный и диффузный слои, ПОИ, ПИ.
Задание 2. Для мицеллы из задания 1 предложите электролит, который вызовет коагуляцию золя, запишите строение мицеллы (ваш вариант) в изоэлектрической точке. Задание 3. Опишите сущность электрокинетических процессов I рода (нечетные варианты) и II рода (четные варианты). Таблица 21
Окончание табл. 21
Лабораторная работа № 9 ПОЛУЧЕНИЕ КОЛЛОИДНЫХ РАСТВОРОВ Цель работы. изучение способов получения коллоидных растворов конденсационными и дисперсионными методами. Опыт 1. Получение эмульсии масла Выполнение опыта. В пробирку налейте 3 мл дистиллированной воды, добавьте 2 капли растительного масла и, закрыв пробирку, энергично встряхивайте. Получившаяся эмульсия неустойчива, для ее стабилизации добавьте несколько капель 1%-го раствора стабилизатора: 1) NaOH, 2) Na2CO3, 3) раствора мыла. Задание. Напишите строение мицеллы. В выводе объясните, почему устойчивость эмульсии возрастает в присутствии стабилизатора. Опыт 2. Получение различных золей берлинской лазури Fe4[Fe(CN)6] Выполнение опыта. а) В пробирку поместите 1 мл 0,1%-го раствора K4[Fe(CN)6], затем при взбалтывании добавьте 3 – 4 капли 2%-го раствора FeCl3 (получается темно-синий золь). б) В пробирку поместите 1 мл 2%-го раствора FeCl3, а затем прибавьте при взбалтывании 2 – 3 капли 0,1%-го раствора K4[Fe(CN)6] (получается золь зеленого цвета). Задание. Для синего и зеленого золей берлинской лазури напишите формулы мицелл с (+) и (–) гранулами. В выводе объясните, чем определяется заряд гранулы. Опыт 3. Получение золя железосинеродистой меди Cu2[Fe(CN)6] Выполнение опыта. В пробирку поместите 1 мл 0,1%-го раствора K4[Fe(CN)6], затем добавьте 0,5 мл 1%-го раствора сульфата меди. Получите золь красно-коричневого цвета. Задание. Напишите строение мицеллы. Опыт 4. Получение золя MnO2 Выполнение опыта. К 5 каплям 0,5%-го раствора Н2О2 прибавьте Задание. Напишите формулу мицеллы. Опыт 5. Получение золя гидроксида железа Выполнение опыта. К 3 мл кипящей воды в пробирке быстро, но по каплям, прилить 10 капель 2%-го раствора FeCl3. Образуется золь красно-бурого цвета. Задание. Напишите формулу мицеллы золя гидроксида железа. Опыт 6. Определение порога коагуляции Выполнение опыта. Согласно правилу коагуляции следует подобрать из растворов (KCl, CaCl2, AlCl3, K3[Fe(CN)6], K2SO4) по три электролита с последовательно изменяющимся зарядом ионов, способных вызвать коагуляцию положительного или отрицательного золя. В качестве положительного золя возьмите золь гидроксида железа, отрицательного – золь железосинеродистой меди (полученные в опытах 3
В три пробирки налейте по 1 мл исследуемого золя. В первую пробирку налейте из бюретки определенное количество электролита с одновалентным коагулирующим ионом до помутнения раствора, во вторую – с двухвалентным ионом, в третью – с трехвалентным ионом. Порог коагуляции в ммоль на 1 литр золя рассчитайте: C порог. = 500 СХ, где С – молярная концентрация электролитов; Х – минимальное количество электролита, вызывающего коагуляцию золя. Таблица 22
Задание. Результаты внесите в две таблицы (табл. 22, отдельно для положительного золя и отдельно для отрицательного). Обоснуйте выбор электролитов. Сделайте вывод о зависимости С порог от заряда коагулирующего иона. Опыт 7. Взаимная коагуляция золей Выполнение опыта. В пяти пробирках смешайте золи Fe(OH)3 и Cu2[Fe(CN)6] в количествах, указанных в табл. 23. Через некоторое время запишите в таблицу степень коагуляции (полная, неполная и др.) и цвет жидкости над осадком. Если во всех пробирках жидкость над осадком окрашена в цвет одного из золей, то это указывает на избыточное количество этого золя. Разбавлением этого золя можно добиться при повторной постановке опыта полной взаимной коагуляции золей в одной из пробирок. Таблица 23
Задание. Заполните таблицу. Сделайте вывод о физической природе взаимной коагуляции золей. Опыт 8. Очистка воды коагуляцией (опыт желательно поставить в начале лабораторной работы). Выполнение опыта. В пять пробирок налейте по 10 мл мутной воды (0,1 г глины на 1 л воды) и в каждую пробирку добавьте различное количество золя гидроксида железа: 1, 2,4, 8, 16 капель. В шестую пробирку налейте 10 мл мутной воды для сравнения. Перемешайте. Результаты запишите в табл. 24 через 0,5 и 1 ч (оцените степень очистки воды от мути по 10-балльной шкале). Таблица 24
Задание. Заполните таблицу. Запишите строение мицеллы глины, от которой необходимо было избавиться, и строение мицеллы гидроксида железа. Объясните эффект гетерокоагуляции.
9.ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ Электрохимия – раздел химии, изучающий химические превращения на гетерогенной границе между электродами I и II рода с участием свободных электронов. Проводником 1 рода являетсяметаллический провод или изделие, в котором существует электронная проводимость. Проводник 2 рода – этораствор сильного электролита, в котором реализуется ионная проводимость. Электрохимические процессы – это процессы, протекающие на границе раздела электрод–электролит, т.е. в электрохимических системах. Электрохимические системы – это системы, в которых энергия химических реакций превращается в электрическую энергию (гальванические элементы) или, напротив, накопление электрической энергии приводит к химической реакции (электролизеры).
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Теоретическая часть Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называют химическими источниками электрической энергии, или гальваническими элементами (ГЭ).
 Действие их основано на протекании окислительно-восстанови-тельной реакции. Если оба металла (электроды) в ГЭ соединены металлическим проводником (элек-тронная проводимость), то в результате электрической проводимости растворов электролитов (ионная проводимость) получается замкнутая электрическая цепь. Электроны будут перемещаться от металла с меньшим значением Е 0 (стандартный электродный потенциал) к металлу с большим значением Е 0 через внешний участок цепи, а в растворе электролитов катионы будут двигаться к металлу и разряжаться под действием имеющихся на нем электронов. Результатом этого процесса является возникновение электрического тока в цепи ГЭ. Действие их основано на протекании окислительно-восстанови-тельной реакции. Если оба металла (электроды) в ГЭ соединены металлическим проводником (элек-тронная проводимость), то в результате электрической проводимости растворов электролитов (ионная проводимость) получается замкнутая электрическая цепь. Электроны будут перемещаться от металла с меньшим значением Е 0 (стандартный электродный потенциал) к металлу с большим значением Е 0 через внешний участок цепи, а в растворе электролитов катионы будут двигаться к металлу и разряжаться под действием имеющихся на нем электронов. Результатом этого процесса является возникновение электрического тока в цепи ГЭ.
В простейшем случае ГЭ Даниэля–Якоби состоит из двух стаканов с 1М растворами ZnSO4 и CuSO4. Растворы соединены U-образной стеклянной трубкой, заполненной агар-агаром и насыщенным раствором KCl (электролитический ключ). В раствор ZnSO4 погружена цинковая пластина (Zn-электрод), а в раствор CuSO4 – медная (Cu-элект-род). Электроды соединены металлическим проводником через вольтметр. Схема записи гальванического элемента следующая (указана последовательная схема записи). Анод слева (–) Zn(анодом является тот электрод, для которого алгебраическое значение стандартного электродного потенциала меньше и на котором происходит процесс окисления) Межфазная граница (–)Zn│(вертикальная сплошная черта означает границу раздела твердой и жидкой фаз – место возникновения электродного потенциала)
Электролит анода (–)Zn│ ZnSO4 (электролит, содержащий одноименные ионы погруженного в него электрода)
Электролит катода (–) Zn│ ZnSO4 Межфазная граница (–) Zn│ ZnSO4 Катод справа (–) Zn│ ZnSO4 Полная запись медно-цинкового гальванического элемента Даниэля–Якоби: (–) Zn│ ZnSO4 На электроде, стоящем слева, происходит процесс окисления (отдача электронов): (–) Zn0 – 2e → Zn+2 Освободившиеся электроны с анода переходят на катод, а ионы Zn2+ переходят в раствор. Ионы меди из солевого раствора подходят к Cu-электроду и на нем восстанавливаются. Таким образом, на электроде, стоящем справа, протекает процесс восстановления (принятие электронов): (+) Cu+2 + 2e → Cu0. Избыток анионов из катодного солевого раствора в силу диффузии по электролитическому ключу переходит в катодный раствор, замыкая цепь. В цепи ГЭ возникает электроток, который регистрируется вольтметром. Суммарная окислительно-восстановительная токообразующая реакция (ТОР) Zn0 + Cu+2 → Zn+2 + Cu0 является причиной возникновения тока. Напряжение ГЭ или его электродвижущая сила (ЭДС) представляет собой разность электродных потенциалов катода и анода: ЭДС = Е катод – Е анод. При погружении металла в раствор, содержащий одноименные ионы, в системе возможно установление равновесия: Ме ↔ Ме n + + n e. При равновесии скорость растворения металла равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом металла. Нернст предложил уравнение для расчета величины равновесного потенциала металла:
где Е 0 – стандартный электродный потенциал металла; R – универсальная газовая постоянная 8,3144 Дж/(моль ∙ К); Т – абсолютная температура, К; F – число Фарадея, F = 96500 Кл; n – число электронов, участвующих в электродной реакции; а – активность ионов металла в растворе электролита, моль/л. При переходе от натурального логарифма к десятичному, а также с учетом значения T = 298 К и соответствующих значений R и F получаем выражение для расчета электродного потенциала:
Обучающие задачи Задача 1. Напишите уравнения электродных и суммарной реакций, протекающих в гальваническом элементе, схема которого: (–)Сd│ CdSO4 Рассчитайте изменение энергии Гиббса суммарной реакции ГЭ при стандартных условиях ∆G0 (298 К) и напряжение ГЭ. Решение 1. Стандартный электродный потенциал кадмия ( (–) Сd0 – 2e → Cd2+, (+) Pb2+ + 2e → Pb0. 2. Запишем суммарную токообразующую реакцию: Сd0 + Pb2+ → Cd2+ + Pb0. 3. Рассчитаем изменение энергии Гиббса процесса: ∆ r G0 = ∑∆ f Gпродуктов – ∑∆ f Gисходн. веществ = ∆ f G Cd2+ – ∆ f G Pb2+ = = –77,74 – (–24,3) = –53,44 кДж/моль. Учитываем, что ∆ f GCd0 = ∆ f GPb0 = 0, и стандартные значения энергии Гиббса ионов (приложение 4). 4. Рассчитаем напряжение ГЭ по уравнению:
где n – число электронов участвующих в реакции; F = 96500 Кл/моль; ∆ r G0 = –53440 кДж/моль. Тогда Напряжение ГЭ можно рассчитать также как разницу между электродными потенциалами правого и левого электродов: Е 0ГЭ = Е 0к – Е 0а , Е = –0,13 В – (–0,40 В) = 0,27 В. Задача 2. Рассчитайте напряжение ГЭ, состоящего из никелевого и кадмиевого электродов, если активности ионов в растворах соответственно равны 0,001М и 0,1М. Напишите уравнения электродных реакций. Решение 1. Стандартный электродный потенциал кадмия ( (–) Сd0 – 2e → Cd2+, (+) Ni2+ + 2e → Ni0. 2. Рассчитаем величины электродных потенциалов по уравнению Нернста: Е Ni = –0,25 + (0,0059/2)lg 0,001 = –0,25 + (0,0059/2)(–3) = –0,34 B. E Cd = –0,4 + (0,0059/2)lg 0,1 = –0,4 + (0,0059/2)(–1) = –0,4 B. Е ГЭ = Е к – Е а = –0,34 – (–0,4) = 0,06 B. Задача 3. Стандартный электродный потенциал никеля больше, чем кобальта. Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с активностью 0,001 моль/л, а потенциал кобальта – в растворе с активностью 0,1 моль/л? Решение. Электродный потенциал металла (Е 0) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Следовательно, при изменении условий электродный потенциал кобальта стал больше электродного потенциала никеля. Вопросы для самоконтроля 1. Какое устройство называют гальваническим элементом и из чего оно состоит? 2. От каких параметров зависит напряжение гальванического элемента? 3. Как из пары электродов определить, какой будет в ГЭ являться анодом (катодом)? 4. Какие процессы протекают на аноде и на катоде? 9.1.4. Домашнее задание № 9 Задание 1. Составьте схемы двух гальванических элементов, в одной из которых электрод (см. свой вариант в табл. 25) является катодом, а в другой – анодом. Напишите для каждого ГЭ электродные и суммарные токообразующие реакции (ТОР). Рассчитайте при 298 К изменение энергии Гиббса суммарной реакции элементов Δ r 0G и стандартные ЭДС элементов. Задание 2. Для металлического электрода (из задания 1), погруженного в раствор с концентрацией ионов Таблица 25
Лабораторная работа № 10 ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Цель работы. Изучить устройство и процессы, протекающие в работающем гальваническом элементе, а также влияние концентраций растворов электролитов на напряжение гальванического элемента. Опыт 1. Гальванический элемент Даниэля–Якоби Выполнение опыта. В химические стаканы на 200 мл налейте по 1/2 объема 1М растворы ZnSO4 и CuSO4. В раствор ZnSO4 погрузите предварительно зачищенный с помощью наждачной бумаги цинковый электрод, а в раствор CuSO4 – медный. Растворы соедините электролитическим ключом, а электроды подключите к клеммам вольтметра, соблюдая полюсность. Измерьте напряжение элемента с помощью вольтметра. Задание. Сделайте рисунок ГЭ в отчете и запишите его электрохимическую схему. Напишите уравнения реакций на катоде и аноде и суммарное уравнение реакции. Вычислите теоретическое значение напряжения и рассчитайте погрешность измерения ЭДС. В выводе дайте определение понятию «гальванический элемент». Опыт 2. Влияние концентрации раствора электролита на напряжение гальванического элемента Выполнение опыта. Соберите медно-цинковый элемент по методике, описанной в предыдущем опыте. Налейте в стаканы ZnSO4 и CuSO4 заданной концентрации. Рассчитайте равновесные потенциалы электродов и ЭДС элемента. Активности ионов меди и цинка примите равными их концентрациям. Опыт проведите три раза, меняя концентрацию одного из растворов. Таблица 26
Задание. Определите напряжение ГЭ, как в опыте 1. Результаты расчета запишите в табл. 26. По полученным данным постройте график зависимости ЭДС и напряжения от концентрации. Составьте схему ГЭ, уравнения электродных и токообразующей реакций. В выводе объясните влияние концентрации ионов металла на ЭДС и на напряжение элемента, а также на разность значений ЭДС и напряжений элемента.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1989; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.108.241 (0.119 с.) |
 слева направо разрушающая сила ионов возрастает.
слева направо разрушающая сила ионов возрастает.
 Электролитический ключ (–) Zn│ ZnSO4
Электролитический ключ (–) Zn│ ZnSO4  (служит для снятия диффузного потенциала, обусловленного скоростью диффузии ионов электролита)
(служит для снятия диффузного потенциала, обусловленного скоростью диффузии ионов электролита) ,
, .
. = –0,4 В) меньше, чем потенциал свинца (
= –0,4 В) меньше, чем потенциал свинца ( = –0,13 В), поэтому кадмиевый электрод является анодом и записывается слева, а свинцовый будет катодом, электродом, стоящим справа:
= –0,13 В), поэтому кадмиевый электрод является анодом и записывается слева, а свинцовый будет катодом, электродом, стоящим справа: ,
,
 .
.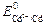 = –0,4 В) меньше, чем потенциал никеля (
= –0,4 В) меньше, чем потенциал никеля ( = –0,25 В), поэтому кадмиевый электрод является анодом и будет расположен слева, а никелевый – катодом и располагается справа:
= –0,25 В), поэтому кадмиевый электрод является анодом и будет расположен слева, а никелевый – катодом и располагается справа: ,
,  . Определим электродные потенциалы этих металлов при данных в условии активностях:
. Определим электродные потенциалы этих металлов при данных в условии активностях: ,
, .
. (см. свой вариант в табл. 25, задание 2), рассчитайте равновесный электродный потенциал Ме. Составьте схему ГЭ, если вторым электродом гальванопары является стандартный водородный электрод. Напишите уравнения электродных реакций и суммарной реакции ГЭ (ТОР). Рассчитайте напряжение ГЭ и сравните с напряжением в стандартных условиях.
(см. свой вариант в табл. 25, задание 2), рассчитайте равновесный электродный потенциал Ме. Составьте схему ГЭ, если вторым электродом гальванопары является стандартный водородный электрод. Напишите уравнения электродных реакций и суммарной реакции ГЭ (ТОР). Рассчитайте напряжение ГЭ и сравните с напряжением в стандартных условиях. , моль/л
, моль/л





