
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения состава раствораСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Состав раствора определяется содержанием растворенного в нем вещества и растворителя. Концентрация – отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы. Известно несколько видов концентрации. Здесь рассмотрим два вида: молярную и массовую. Молярная концентрация – это концентрация количества вещества, равная отношению количества вещества, содержащегося в растворе, к объему раствора:
где Единица измерения молярной концентрации – моль/дм3. Так как
где то Например, молярная концентрация 4,9 г серной кислоты в 250 см3 раствора равна:
Массовая концентрация (титр) – это отношение массы растворенного вещества к объему раствора:
Единицей измерения является г/дм3 или г/см3. Например, массовая концентрация раствора, 100 см3 которого содержат 5 г
Доля используется для выражения состава растворов (смесей) в тех случаях, когда известно количество (масса, объем) как растворенного вещества (компонента), так и раствора (смеси). Наиболее часто используется понятие массовая доля. Массовая доля – это отношение массы растворенного вещества к общей массе раствора:
Массовая доля выражается в долях единицы или в процентах:
Например, массовая доля хлорида натрия в растворе, приготовленном из 5 г
Плотность воды равна:
Экспериментальная часть
Опыт 1. Приготовление раствора бихромата калия (или другой соли) с заданной массовой долей. Рассчитайте, какую массу бихромата калия На электронных весах (с точностью до 0,01 г) определите массу часового стекла и взвесьте на нем вычисленное количество бихромата калия (или другой соли). Отмерьте мензуркой необходимый объем дистиллированной воды. Навеску соли перенесите в стакан емкостью 100 см3. При этом стеклышко обмойте над стаканом небольшим количеством воды из мензурки. Смесь перемешайте до полного растворения кристаллов соли и перенесите в цилиндр. Определите ареометром плотность приготовленного раствора. Раствор сдайте лаборанту.
Все результаты взвешиваний и расчетов запишите в отчет. По таблице 4 найдите массовую долю бихромата калия (или другой соли) в растворе. Установите величину расхождения найденной массовой доли с заданной. Вычислите молярную концентрацию Опыт 2. Приготовление раствора сульфата натрия с заданной молярной концентрацией. Рассчитайте, какую массу кристаллогидрата сульфата натрия На электронных весах отвесьте вычисленное количество сульфата натрия на часовом стекле. В мерную колбу емкостью 100 см3 вставьте воронку диаметром 3,5 см с обрезанным концом. Навеску соли перенесите в колбу. Небольшим количеством дистиллированной воды из мензурки обмойте над воронкой часовое стекло и смойте всю соль в колбу. Постепенно добавляя воду и перемешивая жидкость легкими круговыми движениями, добейтесь полного растворения сульфата натрия в колбе. Объем воды при этом не должен превышать 2/3 объема колбы. После растворения всей соли добавьте воду в колбу до метки. Последние порции воды следует добавлять по каплям из пипетки. Уровень жидкости следует определять по нижнему краю мениска над меткой. Плотно закройте колбу пробкой и перемешайте раствор, несколько раз перевернув колбу вверх дном (4-5 раз). Приготовленный раствор вылейте в цилиндр, измерьте ареометром его плотность и по этой величине найдите массовую долю сульфата натрия в растворе (таблица 5). Раствор сдайте лаборанту. Запишите в отчет порядок и результаты расчета, а также методику приготовления раствора.
Опыт 3. Приготовление раствора серной кислоты с заданной молярной концентрацией. Налейте имеющуюся в лаборатории серную кислоту (массовая доля 0,1-0,15) в цилиндр, определите ареометром ее плотность. Какой массовой доле соответствует найденное значение плотности раствора серной кислоты (таблица 3)? Рассчитайте, какой объем этой кислоты нужно взять для приготовления 100 см3 раствора серной кислоты заданной молярной концентрации. Отмерьте этот объем мерным цилиндром. В мерную колбу емкостью 100 см3 налейте из промывалки дистиллированную воду до
Плотно закройте колбу пробкой и перемешайте раствор, несколько раз перевернув колбу вверх дном. Определите плотность полученного раствора Раствор сдайте лаборанту. Вычислите массовую долю серной кислоты в приготовленном растворе.
Содержание отчета 1. Название и цель работы. 2. Используемые приборы, реактивы и оборудование. 3. Записать в отчет краткие теоретические сведения. 4. Приведите расчеты количества вещества для каждого опыта согласно полученному заданию. 5. Для первого опыта определите молярную концентрацию полученного раствора бихромата калия (или другой соли). 6. Для третьего опыта рассчитайте массовую долю серной кислоты в полученном растворе. 7. Выводы по работе.
Контрольные вопросы
1. Плотность раствора, содержащего 40% 2. В какой массе воды надо растворить 6,72 дм3 3. В каком объеме воды необходимо растворить 4. Найдите молярную концентрацию раствора гидроксида калия с массовой долей 5. Какой объем раствора хлорида меди (II) концентрации 0,5 моль/дм3, содержащего 20 % этой соли можно приготовить из 50 см3? (
Таблица 3 – Плотность и массовая для кислот и щелочей в водных растворах при 18º С
Продолжение таблицы 3
Таблица 4 – Плотность водных растворов K2Cr2O7
Таблица 5 – Плотность водных растворов
ЛАБОРАТОРНАЯ РАБОТА № 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 575; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.209.237 (0.008 с.) |

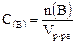 ,
, – количество вещества (в моль);
– количество вещества (в моль); 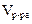 – объем раствора (дм3).
– объем раствора (дм3).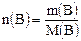 ,
, – масса вещества (г);
– масса вещества (г); 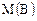 – молярная масса вещества (г/моль),
– молярная масса вещества (г/моль), .
.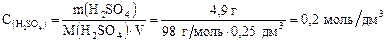 .
. .
. , равна:
, равна: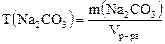 .
. .
.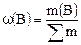 .
. .
. и 195 см3 воды, равна:
и 195 см3 воды, равна: .
. .
. (или хлорида натрия
(или хлорида натрия  ) нужно взять для приготовления 100 г раствора с заданной массовой долей. Какой объем воды следует при этом взять?
) нужно взять для приготовления 100 г раствора с заданной массовой долей. Какой объем воды следует при этом взять? нужно взять для приготовления 100 см3 раствора этой соли заданной концентрации.
нужно взять для приготовления 100 см3 раствора этой соли заданной концентрации. части объема колбы. Перемешивая жидкость в колбе круговыми движениями, через воронку понемногу перелейте в нее всю кислоту из мерного цилиндра. Сполосните воронку водой, достаньте ее и дождитесь охлаждения колбы до комнатной температуры. Затем, добавляя воду, доведите уровень жидкости в колбе до метки. Последние порции воды следует добавлять по каплям из пипетки.
части объема колбы. Перемешивая жидкость в колбе круговыми движениями, через воронку понемногу перелейте в нее всю кислоту из мерного цилиндра. Сполосните воронку водой, достаньте ее и дождитесь охлаждения колбы до комнатной температуры. Затем, добавляя воду, доведите уровень жидкости в колбе до метки. Последние порции воды следует добавлять по каплям из пипетки. .
. , равна 1,25 г/см3. Рассчитайте молярную концентрацию азотной кислоты, если объем раствора равен 600 см3.
, равна 1,25 г/см3. Рассчитайте молярную концентрацию азотной кислоты, если объем раствора равен 600 см3. (объем измерен при н.у.), чтобы получить соляную кислоту, содержащую 9%
(объем измерен при н.у.), чтобы получить соляную кислоту, содержащую 9%  , чтобы получить 400 см3 раствора с массовой долей медного купороса, равной 0,15 и плотностью 1,15 г/см3?
, чтобы получить 400 см3 раствора с массовой долей медного купороса, равной 0,15 и плотностью 1,15 г/см3? , равной 0,22, и плотностью 1,196 см3.
, равной 0,22, и плотностью 1,196 см3.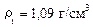 )?
)?



