
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы расстановки коэффициентов в уравнениях ОВРСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Подбор коэффициентов в ОВР осуществляется в соответствии с правилом: количество электронов, отданных восстановителем, должно быть равно количеству электронов, полученных окислителем. На этом правиле основаны 2 метода расстановки коэффициентов: метод учета изменения степеней окисления (метод электронного баланса) и ионно-электронный метод (метод полуреакций).
1. Расстановка коэффициентов методом электронного баланса (МЭБ) Последовательность действий при использовании МЭБ следующая: - выделяем атомы, элементы которых в исходных веществах и продуктах реакции изменяют степень окисления, - составляем электронный баланс присоединения и отдачи электронов, по исходным веществам (для ОВР межмолекулярного гида), или по конечным продуктам (для ОВР внутримолекулярного типа и реакций диспропорционирования); - находим коэффициенты, которые нужно поставить перед формулами веществ, где атомы изменили степень окисления. Для этого сначала находим наименьшее общее кратное для чисел отданных и присоединенных электронов. Соответствующие коэффициенты определяем путем деления наименьшего общего кратного на эти числа; - расставляем найденные коэффициенты сначала перед формулами веществ, в которых атомы изменили степень окисления, а затем перед формулами оставшихся веществ; - проверяем правильность нахождения коэффициентов. Обычно это делают по кислороду. Рассмотрим примеры расстановки коэффициентов в уравнениях ОВР по МЭБ. Пример 1. Расставьте коэффициенты в схеме ОВР:
Конечное уравнение этой реакции: 4FeS2 +11О2 Пример 2. Расставьте коэффициенты в схеме ОВР:
Марганец в КМnO4 находится в высшей степени окисления (+7), значит, КМnO4 – окислитель. Продукты его восстановления зависят от кислотности среды, что можно показать схемой:
В данном примере реакция идет в кислой среде, значит, продукт восстановления перманганата калия – ион Мn2+. Восстановителем будет ион Fe2+, который окисляется до Fe3+:
Основными коэффициентами уравнения будут 1 и 5, но в результате реакции образуется соль Fe2(SO4)3, которая содержит два иона Fe (III), поэтому основные коэффициенты нужно удвоить. Подставляем эти коэффициенты сначала в левую, а потом в правую часть схемы реакция, далее подбираем остальные коэффициенты:
Пример 3. Расставьте коэффициенты в схеме ОВР:
Данная реакция относится к реакциям внутримолекулярного окисления-восстановления. Определяем элементы, атомы которых изменили степень окисления. В данном случае это азот и кислород. Записываем электронные уравнения процессов окисления и восстановления:
Основными коэффициентами уравнения будут (1) и (4), но вступает в реакцию соль Fe(NО3)3, которая содержит три атома N+5, поэтому основные коэффициенты нужно утроить. Подставляем эти коэффициенты (12) и (3) сначала в левую часть. Конечное уравнение этой реакции:
Пример 4. Расставьте коэффициенты в схемах ОВР с участием пероксида водорода. В молекуле Н2О2 атомы кислорода имеют степень окисления (–1), которая является промежуточной между наиболее характерными для кислорода значениями (–2) и (0). Поэтому пероксид водорода в разных условиях может быть как окислителем, так и восстановителем. Уравнения соответствующих реакций окисления-восстановления с участием Н2О2 записываем так: Н2О2-окислитель Н2О2-восстановитель
2. Расстановка коэффициентов методом полуреакций В отличие от метода электронного баланса, в этом методе рассматриваются только ОВР, которые протекают в водных растворах. Нахождение коэффициентов основано на сложении электронно-ионных уравнении для процессов окисления восстановителя (одна полуреакция) и процессов восстановления окислителя (вторая полуреакция) с последующим суммированием уравнений в общее уравнение. В полуреакциях учитывается характер среды, в котором происходит та или иная реакция. Определим последовательность действий при нахождении коэффициентов: 1. Составляем схему процесса. Для этого после написания схемы реакции в молекулярном виде записываем в ионном виде восстановитель, окислитель и продукты их взаимодействия. Сильные электролиты записываем в ионном виде, а слабые электролиты, осадки и газы – в виде молекул. 2. Записываем электронно-ионные уравнения. Чтобы уравнять число атомов кислорода и водорода, которое может входить в состав окисляемых и восстанавливаемых ионов и молекул, необходимо включать в электронно-ионные уравнения молекулы воды и ионы водорода, если реакция протекает в кислой среде, и гидроксид-ионы, если реакция протекает в щелочной среде. При этом возможны два варианта. I вариант В исходных ионах (молекулах) атомов кислорода О-2 больше, чем в получаемых ионах (молекулах). В данном варианте «лишние» атомы кислорода связываются в кислой среде с протонами с образованием молекул воды, а в нейтральной среде с молекулами воды с образованием гидроксид-ионов: О-2+2Н+ = Н20 (кислая среда) О II вариант Если в исходных ионах (молекулах) атомов кислорода меньше, чем в получаемых ионах (молекулах), тогда «недостающие» атомы кислорода берутся в нейтральной и кислой средах из молекул воды, а в щелочной среде из гидроксид-ионов: Н2О = О-2 + 2Н+ (нейтральная и кислая среда); 2ОН– = О–2 + Н2О (щелочная среда). 3. Составляем суммарное ионное уравнение реакции. Для этого уравнения каждую полуреакцию умножаем на такой множитель, чтобы число электронов в процессе окисления было равно числу электронов в процессе восстановления. Затем складываем уравнения обеих полуреакций. 4. Составляем суммарное молекулярное уравнение реакции. Для этого в левой части ионного уравнения подбираем к каждому аниону катион, а к каждому катиону – соответствующий анион. Затем такие же ионы и в той же последовательности записываем в правой части уравнения. Рассмотрим как методом полуреакций находят коэффициенты при протекании ОВР в кислой, нейтральной и щелочной средах. Сначала – случай, когда количество атомов кислорода в исходных веществах больше, чем в продуктах реакции (пример 5), а потом – когда это количество меньше, примеры 6 и 7. Пример 5. Расставьте коэффициенты в схеме ОВР между Na2SО3 и КМnО4 в кислой среде: Na2SО3 + КМnО4 + H2SО4 = Na2SО4 + МnSО4 + K2SО4 + H2О. Здесь степень окисления изменяется у серы и марганца.
Пример 6. Расставьте коэффициенты в схеме ОВР между Na2SО3 и КМnО4 в нейтральной среде: Na2SО3 + КМnО4 + H2О = Na2SО4 + МnО2 + KОН.
Пример 7. Расставьте коэффициенты в схеме ОВР между сульфитом натрия и перманганатом калия в сильно щелочной среде: Na2SО3 + КМnО4 + NaOH
Экспериментальная часть
|
||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 4060; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.17.175 (0.01 с.) |






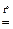 2Fe2O3+8SO2.
2Fe2O3+8SO2. .
.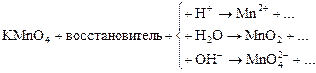 .
.


 .
.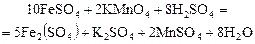 .
. .
.


 .
.

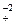 НОН=2ОН– (нейтральная или щелочная среда).
НОН=2ОН– (нейтральная или щелочная среда).

 Na2SО4 + K2МnО4 + Na2МnО4 +H2O.
Na2SО4 + K2МnО4 + Na2МnО4 +H2O.



