
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концентрационные цепи с расплавленными солями.Содержание книги
Поиск на нашем сайте
В концентрационных цепях токообразующий процесс обусловлен различием в концентрациях соответствующего компонента в полуэлементах цепи. (+) Ag|AgNO3, (NaNO3) | | AgNO3, (NaNO3) | Ag, (-) α1 α2 Пусть α1 > α2; E = Токообразующим процессом будет переход AgNO3 из раствора с большей С в раствор с меньшей С. Ток будет течь пока α не станут одинаковыми и ЭДС = 0 Если α1 и ЭДС известно, тогда α2 можно найти из E = - Если два сплава Ме различной С поместить в качестве электродов в расплавленный электролит, содержащий ионы одного из Ме, то получится цепь амальгамного типа (-) Cd(Pb) | CdCl2 | Cd(Pb) (+) α1 > α2 то Е = φправ – φлев = будет переход Cd из сплава с большей α1 в сплав с меньшей α2 α1=1, то найдем α2 из E = - Билет 13 1вольтамперные кривые в ус-ях диф-го перенапряж. дифф перенапряжение:
У-е даёт аналитическое выражение поляризационной зависимости для диффузионного перенапряжения.
При увеличении катодной плотности тока диффузионное перенапряжение будет плавно возрастать. При i®id перенапряжение hD®
2совместное восст-е двух мет. Если р-р электролита содержит катионы более электроплож ме-в чнм основной ме,то их совместный рзряд неизбежен.Если осн мет выдел с бол перенапряж то возможен разряд более электроотриц-х примесей чем осн ме.Пр-с осложняется обр-ем сплава на катоде при этом потенциал каждого ме + те обр-е сплава облегчает разряд катиона,тк уменьшается потенц энергия его компонентов и активоность ме в сплаве мен 1.
1-отраж пр-с восст осн мет 2-достигнута пред плотность тока,соответствует выдел ме2 в усл-ях пред плотности тока. Суммарная поляризационная---
Повышение электродной пол увел выход по току,тк скорость восст ме2 не м/т бол возр 3напряж разлож расплавленных солей. напряжение разложения-мин напряж,которое необходимо преложить из вне что бы происходил длит пр-с электролиза. Если эл-з происходит без перенапряж и поляризации,то напр разл=равновесн эдс.
Электроды сравнения:1)обратимые по отнош к катионам(метал эл-ды-ме погружен в расплав соли этого ме) 2) обрат по отнош к анионам(газовые:хлорный,кислородный) Билет 14 1. Окислительно-восстановительные электроды. В этих системах инертный металл электрода (Pt) является лишь передатчиком электронов между веществами Ox и Red. Например Fe3+ +e D Fe2+ j = j0Fe3+/Fe2+ +
Поясним эту связь для реакции окисления металлического железа до ионов Fe3+. Возможны 2 пути: непосредственное окисление Fe→Fe3+ и окисление через образование Fe2+.
Известно (следствие 1 закона термодинамики) что, если вещество переходит из состояния 1 в состояние 2 и это превращение происходит изотермически и обратимо, то изменение энергии Гиббса не зависит от пути перехода, а определяется только начальным и конечным состояниями. Следовательно, можно записать DG0Fe→Fe3+ = DG0Fe→Fe2+ + DG0Fe2+→Fe3+ DG0 = - zFj0 С помощью правила Лютера удаётся определить стандартные потенциалы и в более сложных случаях. 2. Электрокапиллярные явления отражают связь между поверхностным натяжением и потенциалом электрода. Изменение потенциала электрода (j) вследствие сообщения ему электрических зарядов от внешнего источника ЭДС (поляризация электродов) не должно сопровождаться процессами окисления или восстановления (фарадеевский процесс). Если электрические заряды, сообщаемые электроду, не будут расходоваться на протекание электродных реакций, то, оставаясь на электроде, они будут только изменять только его потенциал, изменяя соответственно только строение ДЭС. Такие электроды называются идеально поляризуемыми. Впервые электрокапиллярные явления были изучены на границе ртути и водных растворов электролитов Липпманом (1875), который использовал для этой цели сконструированный им капиллярный электрометр. Его исследования были продолжены Гуи, Фрумкиным, Батлером и др. Для ряда разбавленных растворов (например, H2SO4, KOH, KNO3, Na2SO4 и др.) форма электрокапиллярной кривой (ЭКК) почти не зависит от природы электролита и близка к параболе (рис.).
Увеличение поверхностного натяжения будет до тех пор, пока не будут нейтрализованы все ионы ртути, тогда поверхностное натяжение принимает максимальное значение σм. Потенциал, при котором σ = σм, называется потенциалом нулевого заряда jq=0. Дальнейшее сообщение отрицательного потенциала приводит к снижению поверхностного натяжения из-за отталкивания частиц, получивших отрицательный избыточный заряд. 3 катодное восст водорода. Электрохимическое восст. Н2 на поверхности рядя металлов протекает с очень большим перенапр.,выше чем в других электр. реакциях. Величина перенапряжения достигает 1В.Велечину перенапряжения можно изменить изменяя плотность тока, состава электролита,темпер.Во многих случаях технического применения эл-за водых р-в высокое перенапр вредно.При электроли получ ме-в за счет выс перенапр уменш кол-во элект-ва,которое расход на ненужное восст водорода 4стадии: 1)Стадия воосст водородного иона их кислого р-ра предст собой разряд катиона Н в щелочн р-х предполаг непосредствен присоединения электронов к молекулам воды с помлед их распадом Н2О+e=Надс +ОН- - щелочная среда 2) закл в образ водорода из адсорбир атомов.Надс +Н Надс +Н2О+e= +Н2+ ОН-- щелочная среда Любая из этих стадий м/т опред скорость всего пр-саэлектролит образ-я водорода и м/т бытьпоявлен водородного перенапряж. При удалении от равновесного потенциала поляризационная зависимость имеет ур. Тафеля: η=а+b lgi Билет 1 напряж на электролиз ванне. Количество электроэнергии, затраченное на получение единицы количества металла (или другого продукта электролиза).
Напряжение можно найти по закону Ома. Удельный расход электроэнергии-расход электроэнергии отнесен к массе получен пр-та при эл-зе 2механизм масса переноса. Перенос реагирующих веществ в условиях электрохимической реакции может осуществляться по трём механизмам. Первый механизм – молекулярная диффузия, то есть перемещение частиц вещества под действием градиента концентрации. При прохождении через границу электрод-электролит электрического тока концентрация реагирующих веществ у поверхности падает и одновременно растёт концентрация продуктов реакции. Прилегающая к электроду область раствора, в которой происходит изменение концентрации раствора, но сохраняется условие электронейтральности, называется диффузионным слоем. Этот слой нужно отличать от диффузной части двойного электрического слоя. Обычно толщина диффузионного слоя на порядок и более превышает толщину диффузной части двойного электрического слоя, а поэтому при решении задач массопереноса полагают, что в первом приближении начало диффузионного слоя соответствует координате x = 0 (ось x направлена вдоль нормали к поверхности электрода). Второй механизм массопереноса – миграция – связан с перемещением заряженных частиц под действием электрического поля, которое возникает в диффузионном слое при прохождении через него электрического тока. Третий механизм массопереноса – конвекция, то есть перенос вещества вместе с потоком движущейся жидкости. В естественных условиях конвекция возникает в результате градиента плотности раствора, который, в свою очередь, является следствием концентрационных или температурных изменений в приэлектродном пространстве. Искусственную (вынужденную) конвекцию создают перемешиванием электролита или вращением самого электрода. Изменение скорости совершается в некотором слое, который называется пограничным слоем d гр, или слоем Прандтля. Передача движения от одного слоя к другому определяется кинематической вязкостью жидкости n. Передача растворённого вещества диффузией определяется коэффициентом диффузии D. n» 10-2 см2/с; D» 10-5 см2/с Для случая естественной конвекции для вертикального расположения электрода
Для вынужденной конвекции, когда ламинарный поток жидкости набегает с одной стороны на пластинчатый электрод id определяется из уравнения
Третий случай конвективной диффузии реализуется при применении вращающегося дискового электрода. Особенностью дискового электрода является постоянство толщины диффузионного слоя в любых точках его поверхности. Предельный ток на дисковом электроде описывается уравнением
электрода.
Электропроводность. Величина электропроводности соли связана с природой химической связи в ней структурными изменениями при плавлении. λ= χ M – молекулярная масса соли, г/моль. m – число атомов металла в молекуле соли. n – валентность катиона. ρ – плотность соли λ – зависит от заряда, подвижности ионов, их количества в единице объема. χ – для бинарных смесей плавно меняется при изменении их состава Электропроводность связана с движением ионов и зависит от их природы и взаимодействия между ними. Числа переноса. 1) В бинарных смесях с общим ионом один сорт покоится например ионы Х- в смесях АХ-ВХ. Это позволяет определить числа переноса А+ и В+ по отношению к ионам Х. Это дает возможность характеризовать свойства ионов одного знака в расплавленных смесях с общими катионами или анионами. (внутренние числе переноса) 2) Числа переноса (t- , t+) можно рассматривать относительно покоящейся массы электролита. Тогда в это время малая часть ионов переносит электричество. (внешние числа переноса) Билет 16 1 Электроды 1 рода. систему, в которой восстановленной формой является металл электрода, а окисленной формой – простые ионы этого же металла. Примером может служить система Cu2+ + 2e D Cu j = j0Cu2+/Cu + относятся амальгамные электроды, в которых восстановленной формой служит амальгама какого-либо металла, а окисленной формой – ионы этого же металлаTl+ + e(Hg) D Tl(Hg) j = j0Tl+/Tl + Электроды 2 рода. система, в которой металл покрыт слоем трудно растворимой соли, а раствор содержит анионы этой соли. Окисленной формой здесь является трудно растворимая соль, а восстановленная форма представлена металлом и анионом. Примеры. Хлорсеребряный электрод AgCl + e D Ag + Cl- j = j0 - Каломельный электрод Hg2Cl2 + 2 e D 2Hg + 2Cl- j = j0 -
|
|||||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 491; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.241.235 (0.008 с.) |

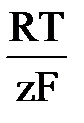 ln
ln 
 φл > φп (т.к. активность Cd одинаковы)
φл > φп (т.к. активность Cd одинаковы)


 . Для анодного процесса:
. Для анодного процесса: 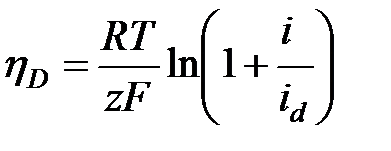 Ур-е показывает, что hD монотонно возрастает с повышением плотности тока.при анодном растворении металла на поляризационной кривой также появляется участок предельного тока, а иногда после достижения определённого потенциала, даже падение плотности тока. Одна из причин может быть то, что в реальных системах рост анодного тока ограничен насыщением раствора продуктами электролиза. Влияние миграции: часть ионов к поверхности электрода может доставляться не только диффузией, но и миграцией, т.е. под действием градиента электрического поля. Ионы переносят часть электрического тока. Число переноса: ti=Ii/I0, в сумме: ti=1. скорость, с которой будут двигаться ионы определяется скоростью миграции
Ур-е показывает, что hD монотонно возрастает с повышением плотности тока.при анодном растворении металла на поляризационной кривой также появляется участок предельного тока, а иногда после достижения определённого потенциала, даже падение плотности тока. Одна из причин может быть то, что в реальных системах рост анодного тока ограничен насыщением раствора продуктами электролиза. Влияние миграции: часть ионов к поверхности электрода может доставляться не только диффузией, но и миграцией, т.е. под действием градиента электрического поля. Ионы переносят часть электрического тока. Число переноса: ti=Ii/I0, в сумме: ti=1. скорость, с которой будут двигаться ионы определяется скоростью миграции  . Суммарная скорость диффузии миграции
. Суммарная скорость диффузии миграции 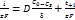 .
. 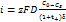
 для миграции. Миграция ускоряет доставку разряжающихся частиц к поверхности электрода. В этом случае числа переноса разряжающегося вещества становятся очень малыми.
для миграции. Миграция ускоряет доставку разряжающихся частиц к поверхности электрода. В этом случае числа переноса разряжающегося вещества становятся очень малыми.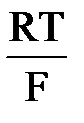 ln
ln  Стандартный потенциал простых окислительно-восстановительных электродов связаны со стандартными потенциалами электродов 1 рода. Поясним эту связь, которая называется правилом Лютера.
Стандартный потенциал простых окислительно-восстановительных электродов связаны со стандартными потенциалами электродов 1 рода. Поясним эту связь, которая называется правилом Лютера. Н2О+e=Надс +Н2О – кислая среда
Н2О+e=Надс +Н2О – кислая среда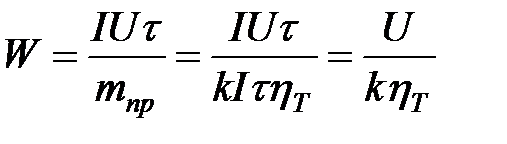 [кВт×ч/кг] U = Er + Eом + Djк + Djа U – напряжение на электролизной ванне, Er – равновесная ЭДС, Eом –омические падения напряжения во всех токоведущих частях электролизёра, Djк, Djа поляризация катода и анода.
[кВт×ч/кг] U = Er + Eом + Djк + Djа U – напряжение на электролизной ванне, Er – равновесная ЭДС, Eом –омические падения напряжения во всех токоведущих частях электролизёра, Djк, Djа поляризация катода и анода.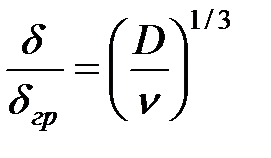 d» 0,1 d гр
d» 0,1 d гр k»0,6; h – высота электрода; r - плотность раствора; g - ускорение силы тяжести.
k»0,6; h – высота электрода; r - плотность раствора; g - ускорение силы тяжести.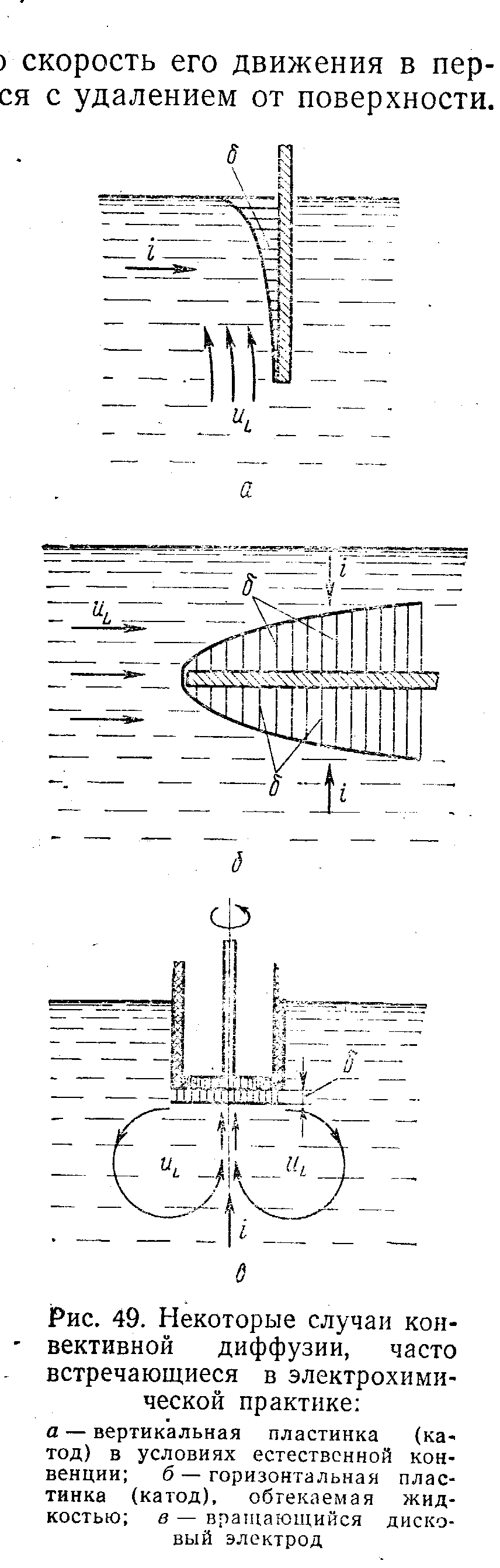
 x – расстояние вдоль электрода.
x – расстояние вдоль электрода.

 ln aCu2+
ln aCu2+ aTl – активность таллия в амальгаме.общую формулу для потенциала электрода 1 рода j1 = j01 +
aTl – активность таллия в амальгаме.общую формулу для потенциала электрода 1 рода j1 = j01 +  ln
ln  где ai – активность потенциалопределяющих ионов в растворе; zi – число электронов, участвующих в электродной реакции; аМ – активность соответствующего металла.
где ai – активность потенциалопределяющих ионов в растворе; zi – число электронов, участвующих в электродной реакции; аМ – активность соответствующего металла. ln aCl-
ln aCl- ln aCl-
ln aCl-


