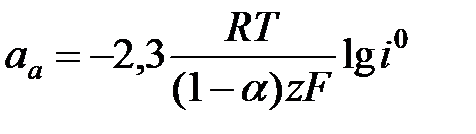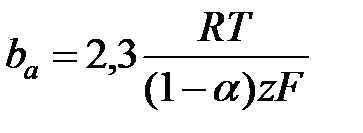Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вывд т/д выраж для равновесн эдсСодержание книги Поиск на нашем сайте
nAA + nBB = nLL + nMM Электрическая работа (энергия) будет равна произведению Е zF (перемещение заряда по замкнутому контуру под действием ЭДС). Тогда DG = - Е zF DG = Smini mi = mi0 + RT ln ai DG = Smi0ni + RT ln ai DG = Smi0ni + RT ln Smi0nI = - RT ln Kр – связь mi0ni с Кр Используя все уравнения получаем:
E = E = E0 - E0 –стандартная ЭДС электрохимической системы.
Налич пав изменяет форму экк,адсорбир-е пав пр-с самопроиз след работа этого пр-са+ и приводит к уменш пов-го наяжения.влияние анионов:макс снижается и смещ-ся в сторону отриц потенц.Сдвиг потенц н.з связван с возник скачка потенц м/ду слоем адсорбированных анионов и притянутых к ним катионам.Влияние орг в-в:макс сниж-ся,снижение бол чем выше концентр пав,в области выс зарядо экк совпадают.вл-е катионов:смещ макс в сторону пол зарядов. Обр-е новой мет фазы на эл-де. Это откл-е-фазовое перенапряж или перенапряж-е критсталлизации.оно возник потому что необходимы затраты энергии на обр-е кристалла в первые моменты времени.Зависимость фазового перенапр от плотности тока м/т иметь разный вид в зависимости от вида обр-ся зародыша.Обр-е электролит осадков ме опр-ся скоростями 2–х параллельно протек-х пр-в:1)появл-е центров критс на катоде хар-ся скоростью появл центров крист-ции2) рост обр-ся зародышей хар-ся скоростью роста.скор ЦК больше скор ре-и-мелко крист-е осадки,наоборот_ккрупнокрист-е осадки
Билет Уравнение Гиббса-Гельмгольца DG = DН - ТDS DН = DG + ТDS DS = - уравнение Гиббса-Гельмгольца: Е = - Частные случаи электрохим перенапряжения 1. Потенциал электрода равен его равновесному значению j = jr. Тогда i = 0; Решение последнего уравнения относительно jr даёт уравнение Нернста для обратимого электродного потенциала 2. Система незначительно отклоняется от равновесия, перенапряжение невелико (h < 25 мВ) zFh < RT. В этом случае каждую экспоненту можно разложить в ряд и ограничится двумя первыми его членами 3. Система существенно отклоняется от равновесия и через неё проходит значительный ток. Если
откуд Влияние природы мет,анионного и катионного со-ва эл-та на хар катодного осадка мет. Все металлы можно условно разделить на три группы: 1) выделяющиеся из водных растворов с очень малым перенапряжением. Для них характерны неустойчивость потенциала во времени, сложный характер роста катодного осадка и другие особенности, свойственные процессу катодного выделения металла. При промышленных плотностях тока эти металлы дают грубые осадки с крупными зёрнами. Ток обмена для этих металлов очень велик. Скорость реакции лимитируется стадией диффузии. 2) образуют более тонкие осадки, имеют меньшие токи обмена и большее перенапряжение. 3)Наибольшая величина перенапряжения и наим токи обмена. Они выделяются на катоде в виде плотных тонкокристаллических осадков. В стационарных условиях общее перенапряжение обусловлено перенапряжением разряда и диффузии. Билет 12 Знак эдс. Е = jп - jл. Следовательно, знак ЭДС устанавливается по положению потенциала правого электрода относительно левого и может быть как положительным, так и отрицательным. За направление тока принимают движение положит. зарядов ЭДС считается положительной, если при замыкании гальванического элемента на внешнее сопротивление электрический ток, за направление которого принимается движение положительных зарядов, течет в электролите (по внутренней цепи) от левого электрода к правому. (ЭДС «+») Электрохимический ряд напр. в 12ВОПРОСЕ (Можно отметить, что более отрицат. нах в окисленном состоянии и более активны,на катоде восст. более полож. элементы, все кто стоит до Н будут окисляться Н) 2электрохим восст-е мет.катодные р-и. катодные р-и: Mez+× x H2O + ze = Me + x H2O MeAx (z-x) + ze = Me + xA- Катодное выделение металла имеет ряд особенностей: 1. В ходе электролиза поверхность катода не постоянна, а непрерывно изменяется вследствие осаждения металла. Надо различать кажущуюся плотность тока, то есть силу тока на единицу геометрической видимой поверхности и истинную, то есть отношение силы тока к активной поверхности осадка. 2. Неустойчивость во времени потенциала катода. Изменения потенциала могут быть связаны с изменением активной поверхности катода (истинной плотностью тока), с изменением перенапряжения при осаждении металла.
3. Примеси ПАВ различных окислителей (например, растворённого кислорода) в электролите изменяют характер роста осадка, величину поляризации. 4. Наличие сопряжённых процессов, например, выделение водорода, изменяют рН раствора вблизи поверхности электрода, что может привести к гидролизу солей и влиять на ход электроосаждения металла.
При осаждении металла на инертном катоде зависимость поляризации от времени при постоянной силе тока может иметь следующий вид:
В нач потенц быстро сдвиг-ся в отриц сторону от равновесного знач,проходит ч/з макс(точ А) затем устанавл На некотором знач-и.После отключ тока(точВ) потенц приним равновесн знач.В(точ А) м/но увид обр-е зародыша.
|
||||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 387; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.169 (0.006 с.) |

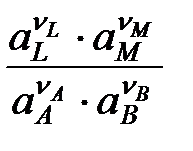
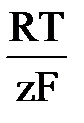 ln Kр -
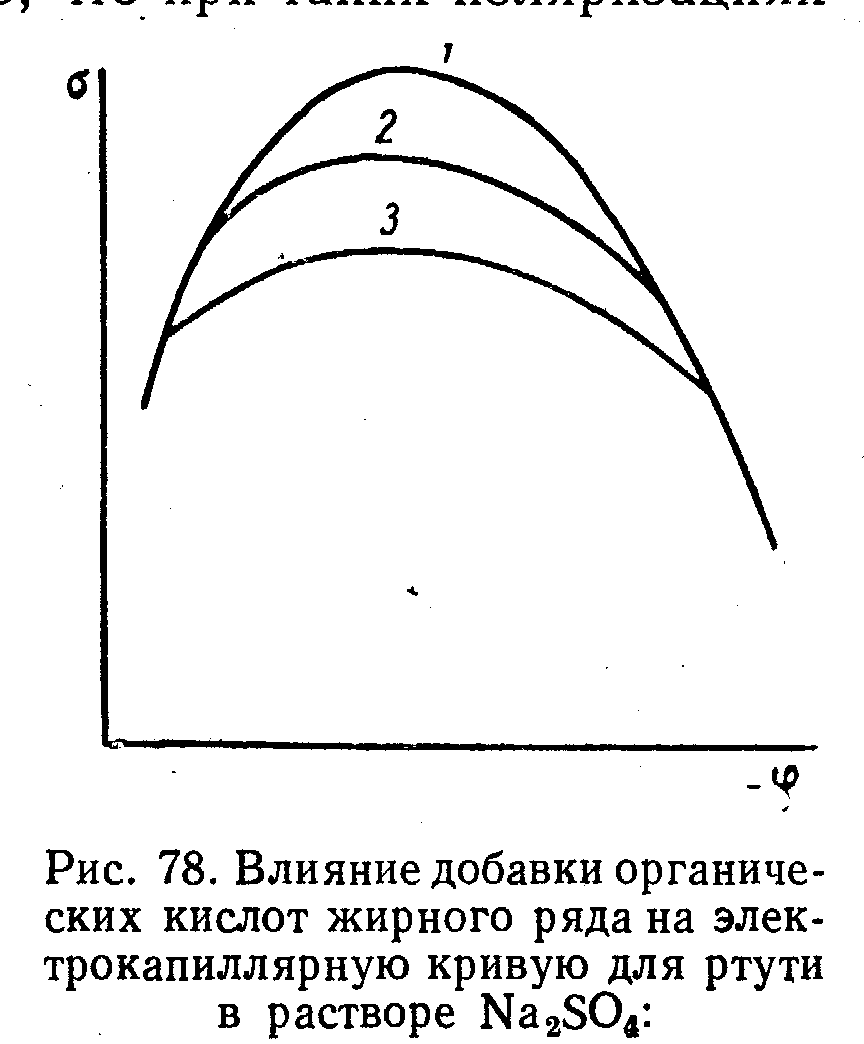
ln Kр - 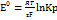 (ур-е Нернста)
(ур-е Нернста)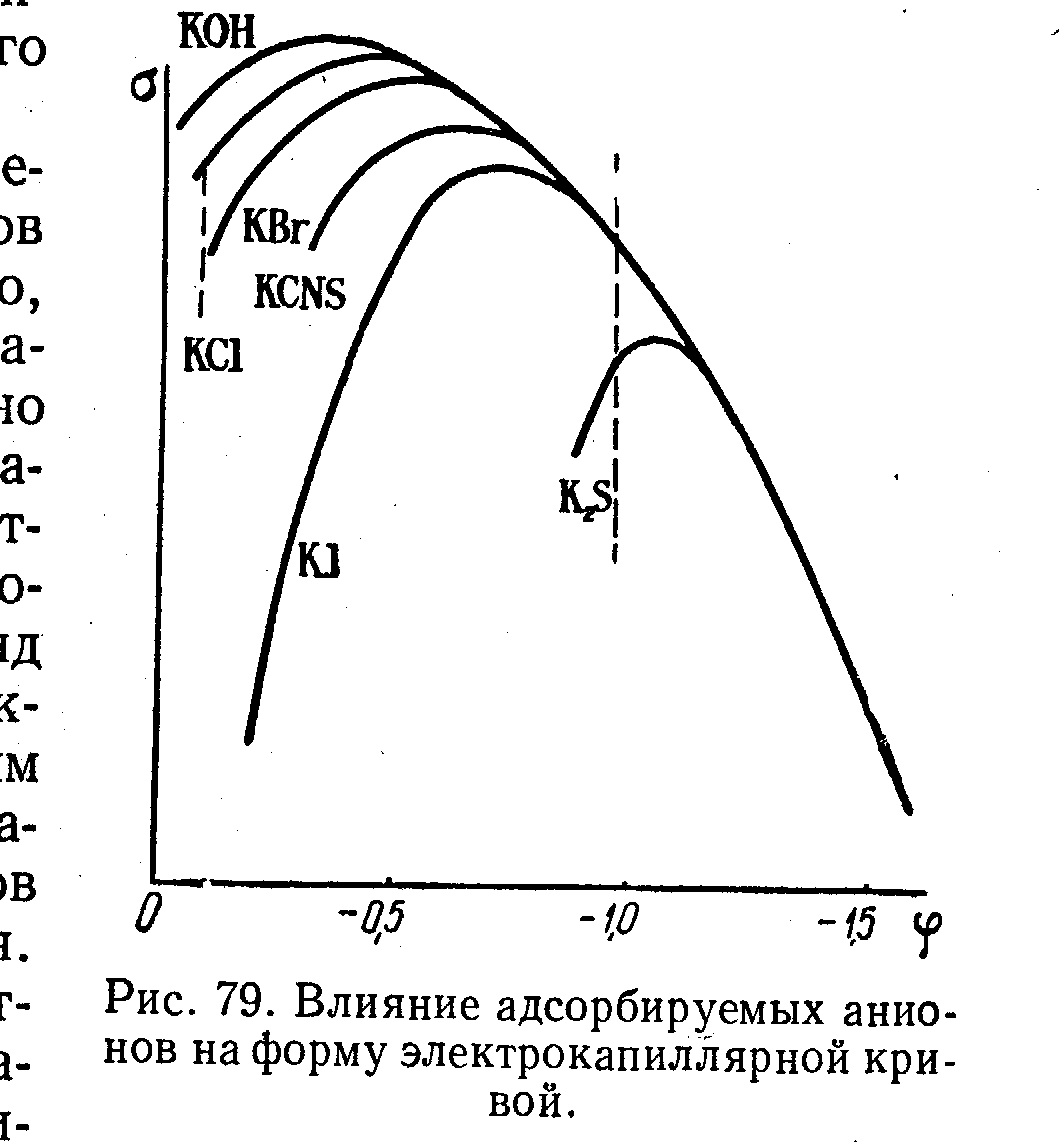
 2 влияние адсорбции на форму экк.
2 влияние адсорбции на форму экк.
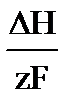 +Т
+Т 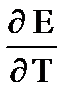 DS = zF
DS = zF  ,
, 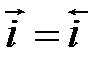 ;
; 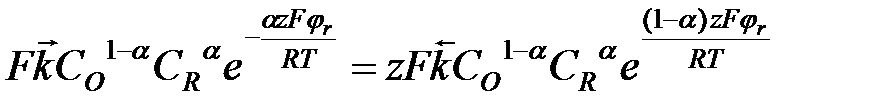
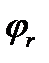 =
= 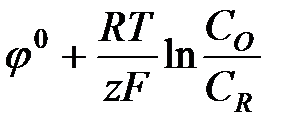
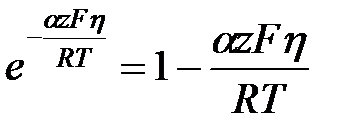
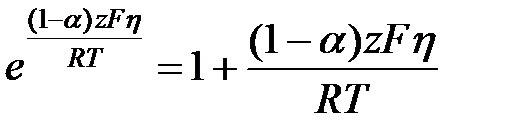 тогда
тогда 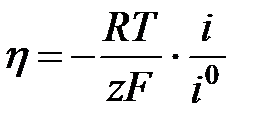
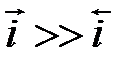 , то есть протекает катодный процесс, то вторым частным током можно пренебречь i =
, то есть протекает катодный процесс, то вторым частным током можно пренебречь i = 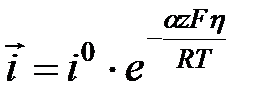
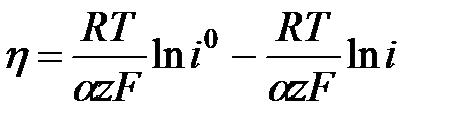 h = a + b lg i уравнение Тафеля. Для случая когда
h = a + b lg i уравнение Тафеля. Для случая когда 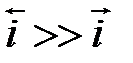 i = ia =
i = ia = 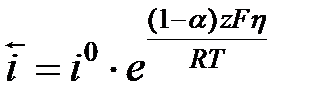 получим уравнение Тафеля для анодного процесса h = aa + ba lg i
получим уравнение Тафеля для анодного процесса h = aa + ba lg i