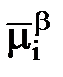Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Величина обратная удельному сопротивлению называется удельной электропроводностью.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте c = 1/r = l /S R = a с z (l+ + l-) Размерность удельной электропроводности Ом-1 м-1 = См/м (См – сименс) Удельная электропроводность раствора характеризует электрическую проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м и расположенными на расстоянии 1 м друг от друга. Эквивалентная электропроводность. Чтобы выделить эффекты ион-ионного взаимодействия, удельную электропроводность c делят на z+n+с, или z-n-с, где с — число молей в единице объема: l = c/z+n+с = c/z-n-с (z+n+с = z-n-с – это число грамм-эквивалентов в единице объёма,г-экв/м3) Величина l называется эквивалентной электропроводностью. li [м2 Ом-1/г-экв]. Она представляет собой электропроводность объёма электролита, содержащего 1 г-экв растворённого вещества и находящегося между двумя параллельными электродами на расстоянии 1м друг от друга. Размерность эквивалентной электропроводности м2 Ом-1 = м2 См, тогда концентрация должна быть выражена в моль/м3. Для бинарного электролита l = c/zс = a с z (l+ + l-)/zc = a (l+ + l-) В растворах сильных электролитов, для которых a®1 l = l+ + l- При бесконечном разведении a®1, тогда l0 = l+0 + l-0 Согласно теории Аррениуса l = a l0 U = Er + Eом + Djк + Djа ; Eом=IR Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц Наступление равновесия между Ме и раствором его соли характеризуется тем, что устанавливается опред. по величине и направлению скачек потенциала или равновесный потенциал. (мера изменения энергии Гиббса) Равновесие препятствует дальнейшему окислению и восстановлению, поэтому равновесный потенциал может служить мерой максим. работы процесса который стремится соверш. на электроде. Ме i=i=iº - ток обмена
Поляризациооные кривые в усл-ях электрохим перенапряжения рассчит-я по ф-летполяризационная кривая симметр относ-но начала координат при отклонении от 0,5 симметричность нарушается.пунктиром показаны поляризационные кривые,отвеч- щие завимисимости частных плотностей токов в прямом и обратном от потенциала. h = a + b lg i- уравнение Тафеля. Величины i0 и a можно найти графически (рис), откладывая h против lg i в той области перенапряжений, где справедливо уравнение Тафеля. Наклон b прямой h - lg i равен
и, следовательно
Ток обмена может быть определён по величине перенапряжения при единичной плотности тока, то есть при lg i = 0. Тогда h=а
Билет 1диффузия в р-рах электролитов. Изменение концентрации (а точнее активности) растворённого вещества в одной части раствора по отношению к другой приводит к возникновению потока диффузии. Количественным выражением процессов диффузии являются законы Фика. Первый закон Фика относится к процессам стационарной диффузии и имеет вид jd = -Di grad ci jd+ = -D+ dc+/dx поток диффузии, то есть количество частиц, диффундирующих через единичную площадку в единицу времени. Di –коэффициент диффузии частиц i, имеет размерность м2/с, показывает число частиц, про диффундировавших за 1с через поперечное сечение раствора площадью 1м2 при градиенте концентрации равном единице. Коэффициенты диффузии ионов связаны с подвижностями ионов следующим образом
jd = -Dэфф grad c В общем случае подвижности катионов и анионов неодинаковы l+0 ¹ l-0 а следовательно не равны и их коэффициенты диффузии D+ ¹ D-, поэтому при одном и том же градиенте концентрации скорость диффузии положительных и отрицательных ионов различна. Предположим, что создана граница между двумя растворами с разной концентрацией. Например, раствор NaCl.
Пусть с1>с2. В водном растворе NaCl D+ < D-. При этом условии анионы в начальный момент времени будут перемещаться слева направо (с1 ®с2) Быстрее чем катионы. В результате этого произойдёт пространственное разделение зарядов и возникнет электрическое поле, которое будет ускорять движение катионов и замедлять движение анионов. Следовательно, через короткий промежуток времени скорости перемещения катионов и анионов выровняются. В этих условиях можно говорить об общем потоке электролита. Однако этот поток не является обычным потоком диффузии, так как между двумя областями раствора с концентрациями с1 и с2 устанавливается стационарная разность потенциалов, которая называется диффузионным потенциалом jd.
Величина диффузионного потенциала будет определяться соотношением
2. Скорость электрохимической реакции Электрохимическую реакцию можно рассматривать как гетерогенную химическую реакцию и скорость её подобно скорости любой химической реакции, определяется как количество вещества, изменившееся за единицу времени, то есть V = ± dDm/dt Поскольку между количеством прореагировавшего вещества и количеством электричества существует прямая пропорциональность, согласно закону Фарадея, то можно записать V = ± dDm/dt = k I dt/dt = k I Скорость электрохимической реакции пропорциональна силе тока. Характерной особенностью всех электрохимических реакций является то, что они совершаются на границе раздела электрод – электролит и поэтому их скорость зависит от величины поверхности раздела. i = I/S - плотность тока [A/см2]. Если электрохимическая цепь работает как электролизёр, то U = Er + Djк + Djа + Eом, а если – как химический источник тока, то U = Er - Djк - Djа - Eом
электродную поляризацию (Dj) можно определить, то есть как разность потенциала электрода, через который протекает ток (ji) и его равновесным потенциалом (jr) Dj = ji - jr Любой электродный процесс всегда имеет ряд последовательных стадий: сначала реагирующее вещество подходит к электроду, затем происходит собственно электрохимическая стадия, связанная с переносом электронов или ионов через границу раздела фаз (стадия разряда-ионизации), и, наконец, образовавшиеся продукты реакции должны отойти от поверхности электрода. Первая и третья стадии имеют одинаковые закономерности и называются стадиями массопереноса. Стадии массопереноса и разряда-ионизации присутствуют во всех без исключения электродных процессах. Помимо этих стадий при протекании электродных реакций встречаются также и другие. Так электродные процессы могут осложняться химическими реакциями в объёме раствора или на поверхности электрода, в которых может участвовать исходное вещество или продукт электрохимической реакции. Скорость процесса, состоящего из ряда последовательных стадий, определяется скоростью самой медленной стадии, которая называется лимитирующей или контролирующей Если известна природа лимитирующей стадии то поляризацию заменяем перенапряжением.виды: Диффузионное перенапряжение возникает при лимитирующей стадии массопереноса; · Электрохимическое перенапряжение (разряда-ионизации) возникает при лимитирующей стадии разряда - ионизации; · Фазовое перенапряжение возникает при лимитирующей стадии построения или разрушения кристаллической решётки или зарождения новой фазы (газовой, жидкой, кристаллической); · Перенапряжение химической реакции возникает при замедленной стадии химической реакции. 3 хим цепи с индивид расплавленными солями и смесями солей. В химических цепях токообразующий процесс связан с взаимодействием чистых компонентов и образованием соответствующей соли. 1) С инд. Расплавленной солью Это цепь с одной солью в качестве электролита, в которой помещены электроды: металлический и газовый. Pb|PbCl2|Cl2,C Е изм будет соответствовать стандартному значению На границе раздела образуется ДЭС и возникает скачек потенциала. Газовые электроды имеют более + φ чем металлические, следовательно возникает разность φ, а в системе ЭДС DG0 = - zFЕ0 DS0 = zF DH0 = DG0 + TDS0 = - zFЕ0 + zFT 2) Химические цепи с расплавленными солевыми смесями Pb|PbCl2, LiCl|Cl2,C; Ag|AgI, KI|I2,C Раствор т/ко Pb как более электроположит, LiCl- фоновый,индифирентный электролит. Токообразующим процессом является процесс образования МеХ2(PbCl2, AgI) из чистых металла и галогена.
Билет 1.скачки на потенц на границе разд фаз. Электродным потенциалом называют ЭДС электрохимической цепи, в которой слева находится стандартный водородный электрод, потенциал которого условно принят за нуль, а справа - данный электрод.
Работа перенесения заряженной частицы из фазы a в фазу b будет равна разности её электрохимических потенциалов в этих фазах, то есть Электрохимический потенциал частицы i в фазе a равен работе перенесения моля данного компонента i из бесконечности в вакууме внутрь данной фазы. ga - gb - разность внутренних потенциалов называется гальвани потенциалом и обозначается как gab.В условиях равновесия gab = (mia - mib)/ ziF ЭДС электрохимической системы, которая представляет собой сумму скачков потенциала на границах раздела фаз, является в то же время суммой всех гальвани потенциалов. Е = gМ1L1 + gL1L2 + gL2M2 + gМ2M1 Если в электрохимической системе потенциал gL1L2 отсутствует, то Е = gМ1L1 - g M2L2 - gМ1M2 С другой стороны ЭДС представляет собой разность двух электродных потенциалов, то есть Е = jп - jл 2. Концентрационные электрохим. цепи Оба электрода идентичны по физическому состоянию и по химической природе. Они отличаются концентрацией компонентов Ox и Red. Источником электрической энергии является разность свободных энергий Гиббса, обусловленная различными активностями одних и тех же химических компонентов. Концентрационные цепи можно приготовить следующим образом: 1.Из амальгам разных концентраций в одном и том же растворе; 2.Из одинаковых электродов 1 и 2 рода, находящихся в растворах разной концентрации (активности); 3.Из одинаковых газовых электродов, работающих при разных давлениях. Различают концентрационные цепи без переноса и с переносом. При работе концентрационных цепей идёт выравнивание активностей или давлений. Cu çZn (Hg)(a1) ç ZnSO4 ç Zn (Hg)(a2) çCu цепь без переноса Если а1 > а2, то левый электрод – анод, а правый – катод. E = jк - jа = RT/2F ln a1/a2Zn ç ZnSO4 (а’)çç ZnSO4 (a’’)ç Zn цепь с переносом Если а’ < а’’, то левый электрод – анод, а правый – катод. E = jк - jа = RT/2F ln a’’/a’ К: Cu2++2e=Cu0 А: Cu0-2e=Cu2+ 3. электролиз расплавленных солей широко используется для получения легких, тугоплавких, редких металлов, сплавов, фтора, хлора, для рафинирования металлов. Применение электролиза расплавленных солей весьма перспективно для получения сплавов и соединений, а так же для нанесения гальванических покрытий и обработки поверхности металлов. · высокая интенсивность процесса, которая может в 25-100 раз превышать интенсивность электролиза водных растворов; · возможность работы в широком диапазоне температур и концентрацией электролита; значительное сокращение расхода воды. · значительный удельный расход электроэнергии, · повышенные капитальные и эксплуатационные затраты на охрану окружающей среды, В настоящее время считается, что расплавленные соли близки по своему строению к твердому веществу. Расплавленные соли при температурах, близких к температуре плавления, наследуют структуру твердого в-ва. Структура твердого кристалла характеризуется дальним порядком, т.е. правильным расположением частиц одна около другой во всем объеме кристалла.Но имеются разл дефекты.они увел-ся с увел-ем темп-ры,тем самым уменьшают дальний порядок.При переоде в жидкое сост-е дальний порядок полностью нар-ся,но созр ближний порядок.ряд солей имеют молекулярную стр-ру при их нагревании стр-ра сохр,расплав становится непроводящим.Для некоторых солей характерна слоистая стр-ра, в этом случае кристалл состоит из отдел-х пакетов.
Билет 1. ДЭС При соприкосновении двух фаз, имеющих заряженные частицы, возможен переход таких частиц в неэквивалентном количестве из фазы в фазу. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется так называемый двойной электрический слой (ДЭС), разность зарядов между обкладками которого, обуславливает скачок потенциала. Примером может служить поверхность раздела между металлом и водным раствором электролита. ДЭС может образовываться и без перехода заряженных частиц из фазы в фазу. В этом случае образование ДЭС возможно за счёт избирательной адсорбции ионов одной из фаз на поверхности другой. ДЭС может образоваться при адсорбции и ориентации полярных молекул жидкой фазы (например, воды) на поверхности твёрдого тела. Ме Меz+ + ze (A) окисление Ме Меz+ + ze (B) восстановление Скорости прямого и обратного процессов неодинаковы Скорость восстановления и окисления можно измерять плотностью тока реакция А i реакция B i По мере увеличения этих зарядов скорость реакции В будет уменьшаться, а скорость реакции А увеличиваться до наступления равновесия
|
||||||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 1162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

 скорости выравниваются
скорости выравниваются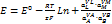

 - не зависит от активности участников процесса, а опред. лишь природой электрода и раствора.(a=1).Величины
- не зависит от активности участников процесса, а опред. лишь природой электрода и раствора.(a=1).Величины 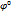 можно измерить на основе ТД данных,является константой.если отриц то металл будет окисл водородом.если положит то не б\т окисляться
можно измерить на основе ТД данных,является константой.если отриц то металл будет окисл водородом.если положит то не б\т окисляться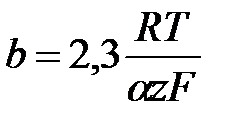
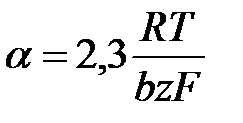
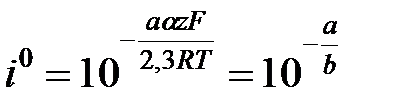
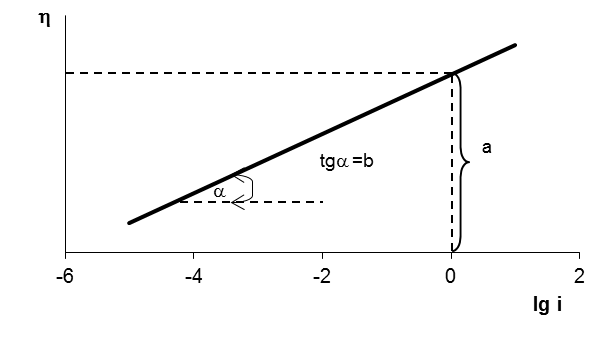 Рис. Определение тафелевских констант а и b из полулогарифмических зависимостей перенапряжения от плотности тока
Рис. Определение тафелевских констант а и b из полулогарифмических зависимостей перенапряжения от плотности тока
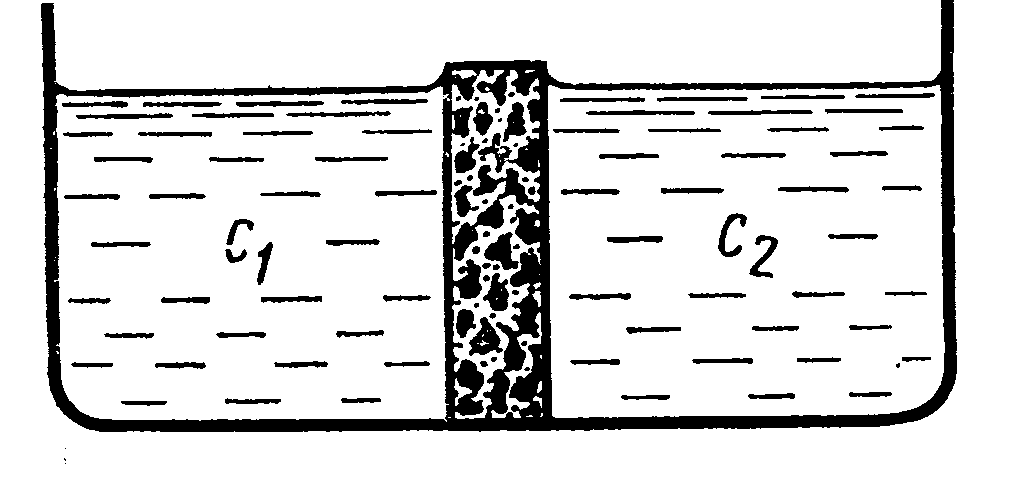

 - эффективный коэффициент диффузии электролита. Термин эффективный отражает то, что в действительности перемещение ионов происходит не только за счёт диффузии, но и под действием электрического поля (миграции).
- эффективный коэффициент диффузии электролита. Термин эффективный отражает то, что в действительности перемещение ионов происходит не только за счёт диффузии, но и под действием электрического поля (миграции).
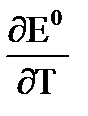
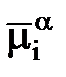 = mia ± ziFga;
= mia ± ziFga;