
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Причины отклонения от законов Фарадея.Содержание книги Поиск на нашем сайте Билет 1. Многие цвет ме-лы (нем-лы) пол-ют и рафинируют электролизом водных р-ров электролитов и расплав солей. Элек-зом водных р-ов получ Zn,Cd,Sb,Mn. Cu,Ni,Pb,Bi,благ и ред ме-в подвергают электролит-й очистке.AI,Mg пром-ть, получение щелочных, щелочноземельных ме-в, рафинирование основаны на электролизе расплавленных солей. Особенности химических реакций: Необходим контакт реагирующих частиц.2)Путь электрона, который переходит с одной частицы на другую, является очень коротким.3)Столкновение между реагирующими частицами происходит хаотично, поэтому электронные переходы могут совершаться в любых направлениях в пространстве. Особенности электрохимических реакций.1)Пространственное разделение участников реакции.2)Прямой контакт между реагирующими частицами заменяется контактом каждого из его участников с электродом.3)Скорость электрохимической реакции зависит от температуры, активности, природы участников реакций и электродов, и электродного потенциала. Гальванический элемент - электрохимическая система, производящая электрическую энергию за счёт протекающих в ней химических превращений. Электролизер - электрохимическая система, в которой за счёт внешней электрической энергии совершаются химические превращения. Составные части электрохим систем: 1)р-р электролита-проводник 2 рода в котором реагирующие в-ва диссоциируют на ионы 2)2 проводника 1 рода(электроды),контактирующие с электролитом и обеспещивающие обмен электронами с участниками р-и. 3)проводник 1 рода,соед э-ды между собо,либо с внешним источником тока 2. Электрохимическое перенапряжение возникает, если электрохтм акт,в котором участвуют ионы плоьной части дэс ограничивает скорость всего электродного пр-са(лимитирующая стадия-пр-с разряда-ионизации) Поляризационные зависимости для частных плотностей тока
При равновесии Катодная плотность тока
Анодная плотность тока
3.растврим ме-в в расплавленных солях при электролит получ ме-в происх расвор-е ме в солевой фазеСпособность металлов растворяться в электролите – главная причина снижения выхода по току и ухудшения показателей электролиза. Растворимость металла зависит от природы металла и соли, состава металлической и солевой фаз и температуры. Большая взаимная растворимость наблюдается в системах с Na, Rb, Ce, K с галогенидами Механизмы растворения (Ме – соль): 1) Растворение металлов с последующей их ионизацией Ме = Меz+ + ze 2) Растворение металлов как результат их реакции с собственной солью с образованием более сложных ионов Меz+ + nMe 3) Растворение металлов как результат их реакции с собственной солью с образованием ионов низшей валентности Меz+ + nMe K(2)=
Билет 1. Законы Фарадея.Электролиз - протекание химических реакций на электроде, обусловленое прохождением электрического тока. 1. Количество вещества, прореагировавшего на границе электрод-электролит при протекании через неё электрического тока, прямо пропорционально количеству электричества, прошедшего через эту границу. Dm = к×Q k -электрохимический эквивалент; Q -количество электричества, Кл. Q = I×t 2.При электролитическом разложении различных веществ одним и тем же количеством электричества, количества полученных на электродах продуктов разложения пропорциональны их химическим эквивалентам
Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы. Величина электрохимического эквивалента-массы пр-в р-и,обр-ся при прохождении кол-ва электричества=1Кл определяется как: 2. Газовые электроды. Газовый электрод состоит из инертного металла (Pt), к которому подводится электрохимически активный газ. Газ адсорбируется и участвует в электродной реакции. Например, водородный электрод. H+ + e D 1/2 H2 j = Если PH2 = 1атм, то j = RT/F ln aH+ = 2,3 RT/F lg aH+ = b pH При определенных условиях потенциал водородного электрода является непосредственным выражением величины рН. Кислородный электрод. O2 + 2H2O + 4e = 4 OH- (нейтр. среда.) j = j0 + 3.модели. 1Модель плоского конденсатора (Гельмгольц)-дэс можно уподобить плоскому конденсатору 1 из обкладок конденсатора проходит ч\з центры тяжести зарядов ионов и совпадает с плоскостью пов ме-ла,другая прох ч\з центры тяжести ионов,нах-ся в р-ре м\ду обкладками действ силы эл.ст притяжения.толщина дэс=расстоянию м\ду этими обкладками и=радиусу иона,объясняет форму экк,но не объясняет зависимость емкости и 2(Гуи-Чапмен)вследствии движения мол и ионов дэс со стороны р-ра приоьретает размытое сост-е-диффузная модель.Дей-ют силы теплового движения ч-ц, об-ет зав-ть емкости и 3 Адсорбционная теория строения ДЭС (Штерн)-учит-ся силы специфич адсорбции ионов и мол-л.ионы и мол-лы способны адсорбироваться на пов-ти эл-да за счет сил неэектраст-го х-ра.стр-е дэс указывает на ха-р перехода и скорость.
Билет 1. Выход по току дает ту часть количества электричества прошедшего через электролизер, которая приходится на долю данной электродной реакции.
М\но так же определить выход по току как отношение количества полученного продукта к теоретическому количеству, которое должно получиться согласно закону Фарадея. Билет 1. Удельная электропроводность Билет 1диффузия в р-рах электролитов. Изменение концентрации (а точнее активности) растворённого вещества в одной части раствора по отношению к другой приводит к возникновению потока диффузии. Количественным выражением процессов диффузии являются законы Фика. Первый закон Фика относится к процессам стационарной диффузии и имеет вид jd = -Di grad ci jd+ = -D+ dc+/dx поток диффузии, то есть количество частиц, диффундирующих через единичную площадку в единицу времени. Di –коэффициент диффузии частиц i, имеет размерность м2/с, показывает число частиц, про диффундировавших за 1с через поперечное сечение раствора площадью 1м2 при градиенте концентрации равном единице. Коэффициенты диффузии ионов связаны с подвижностями ионов следующим образом
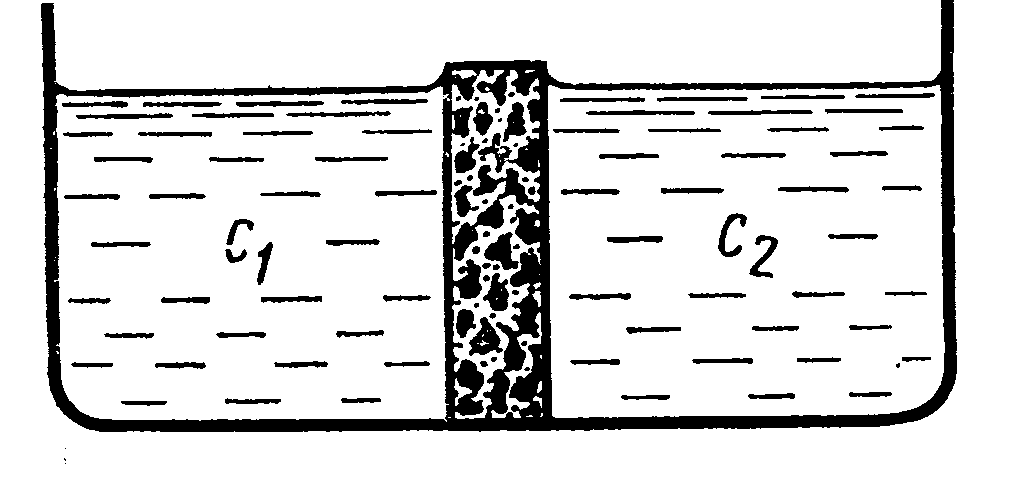
jd = -Dэфф grad c В общем случае подвижности катионов и анионов неодинаковы l+0 ¹ l-0 а следовательно не равны и их коэффициенты диффузии D+ ¹ D-, поэтому при одном и том же градиенте концентрации скорость диффузии положительных и отрицательных ионов различна. Предположим, что создана граница между двумя растворами с разной концентрацией. Например, раствор NaCl.
Пусть с1>с2. В водном растворе NaCl D+ < D-. При этом условии анионы в начальный момент времени будут перемещаться слева направо (с1 ®с2) Быстрее чем катионы. В результате этого произойдёт пространственное разделение зарядов и возникнет электрическое поле, которое будет ускорять движение катионов и замедлять движение анионов. Следовательно, через короткий промежуток времени скорости перемещения катионов и анионов выровняются. В этих условиях можно говорить об общем потоке электролита. Однако этот поток не является обычным потоком диффузии, так как между двумя областями раствора с концентрациями с1 и с2 устанавливается стационарная разность потенциалов, которая называется диффузионным потенциалом jd.
Величина диффузионного потенциала будет определяться соотношением
2. Скорость электрохимической реакции Электрохимическую реакцию можно рассматривать как гетерогенную химическую реакцию и скорость её подобно скорости любой химической реакции, определяется как количество вещества, изменившееся за единицу времени, то есть V = ± dDm/dt Поскольку между количеством прореагировавшего вещества и количеством электричества существует прямая пропорциональность, согласно закону Фарадея, то можно записать V = ± dDm/dt = k I dt/dt = k I Скорость электрохимической реакции пропорциональна силе тока. Характерной особенностью всех электрохимических реакций является то, что они совершаются на границе раздела электрод – электролит и поэтому их скорость зависит от величины поверхности раздела. i = I/S - плотность тока [A/см2]. Если электрохимическая цепь работает как электролизёр, то U = Er + Djк + Djа + Eом, а если – как химический источник тока, то U = Er - Djк - Djа - Eом
электродную поляризацию (Dj) можно определить, то есть как разность потенциала электрода, через который протекает ток (ji) и его равновесным потенциалом (jr) Dj = ji - jr Любой электродный процесс всегда имеет ряд последовательных стадий: сначала реагирующее вещество подходит к электроду, затем происходит собственно электрохимическая стадия, связанная с переносом электронов или ионов через границу раздела фаз (стадия разряда-ионизации), и, наконец, образовавшиеся продукты реакции должны отойти от поверхности электрода. Первая и третья стадии имеют одинаковые закономерности и называются стадиями массопереноса. Стадии массопереноса и разряда-ионизации присутствуют во всех без исключения электродных процессах. Помимо этих стадий при протекании электродных реакций встречаются также и другие. Так электродные процессы могут осложняться химическими реакциями в объёме раствора или на поверхности электрода, в которых может участвовать исходное вещество или продукт электрохимической реакции. Скорость процесса, состоящего из ряда последовательных стадий, определяется скоростью самой медленной стадии, которая называется лимитирующей или контролирующей Если известна природа лимитирующей стадии то поляризацию заменяем перенапряжением.виды: Диффузионное перенапряжение возникает при лимитирующей стадии массопереноса; · Электрохимическое перенапряжение (разряда-ионизации) возникает при лимитирующей стадии разряда - ионизации; · Фазовое перенапряжение возникает при лимитирующей стадии построения или разрушения кристаллической решётки или зарождения новой фазы (газовой, жидкой, кристаллической); · Перенапряжение химической реакции возникает при замедленной стадии химической реакции. 3 хим цепи с индивид расплавленными солями и смесями солей. В химических цепях токообразующий процесс связан с взаимодействием чистых компонентов и образованием соответствующей соли. 1) С инд. Расплавленной солью Это цепь с одной солью в качестве электролита, в которой помещены электроды: металлический и газовый. Pb|PbCl2|Cl2,C Е изм будет соответствовать стандартному значению На границе раздела образуется ДЭС и возникает скачек потенциала. Газовые электроды имеют более + φ чем металлические, следовательно возникает разность φ, а в системе ЭДС DG0 = - zFЕ0 DS0 = zF DH0 = DG0 + TDS0 = - zFЕ0 + zFT 2) Химические цепи с расплавленными солевыми смесями Pb|PbCl2, LiCl|Cl2,C; Ag|AgI, KI|I2,C Раствор т/ко Pb как более электроположит, LiCl- фоновый,индифирентный электролит. Токообразующим процессом является процесс образования МеХ2(PbCl2, AgI) из чистых металла и галогена.
Билет 1.скачки на потенц на границе разд фаз. Электродным потенциалом называют ЭДС электрохимической цепи, в которой слева находится стандартный водородный электрод, потенциал которого условно принят за нуль, а справа - данный электрод.
Работа перенесения заряженной частицы из фазы a в фазу b будет равна разности её электрохимических потенциалов в этих фазах, то есть Электрохимический потенциал частицы i в фазе a равен работе перенесения моля данного компонента i из бесконечности в вакууме внутрь данной фазы. ga - gb - разность внутренних потенциалов называется гальвани потенциалом и обозначается как gab.В условиях равновесия gab = (mia - mib)/ ziF ЭДС электрохимической системы, которая представляет собой сумму скачков потенциала на границах раздела фаз, является в то же время суммой всех гальвани потенциалов. Е = gМ1L1 + gL1L2 + gL2M2 + gМ2M1 Если в электрохимической системе потенциал gL1L2 отсутствует, то Е = gМ1L1 - g M2L2 - gМ1M2 С другой стороны ЭДС представляет собой разность двух электродных потенциалов, то есть Е = jп - jл 2. Концентрационные электрохим. цепи Оба электрода идентичны по физическому состоянию и по химической природе. Они отличаются концентрацией компонентов Ox и Red. Источником электрической энергии является разность свободных энергий Гиббса, обусловленная различными активностями одних и тех же химических компонентов. Концентрационные цепи можно приготовить следующим образом: 1.Из амальгам разных концентраций в одном и том же растворе; 2.Из одинаковых электродов 1 и 2 рода, находящихся в растворах разной концентрации (активности); 3.Из одинаковых газовых электродов, работающих при разных давлениях. Различают концентрационные цепи без переноса и с переносом. При работе концентрационных цепей идёт выравнивание активностей или давлений. Cu çZn (Hg)(a1) ç ZnSO4 ç Zn (Hg)(a2) çCu цепь без переноса Если а1 > а2, то левый электрод – анод, а правый – катод. E = jк - jа = RT/2F ln a1/a2Zn ç ZnSO4 (а’)çç ZnSO4 (a’’)ç Zn цепь с переносом Если а’ < а’’, то левый электрод – анод, а правый – катод. E = jк - jа = RT/2F ln a’’/a’ К: Cu2++2e=Cu0 А: Cu0-2e=Cu2+ 3. электролиз расплавленных солей широко используется для получения легких, тугоплавких, редких металлов, сплавов, фтора, хлора, для рафинирования металлов. Применение электролиза расплавленных солей весьма перспективно для получения сплавов и соединений, а так же для нанесения гальванических покрытий и обработки поверхности металлов. · высокая интенсивность процесса, которая может в 25-100 раз превышать интенсивность электролиза водных растворов; · возможность работы в широком диапазоне температур и концентрацией электролита; значительное сокращение расхода воды. · значительный удельный расход электроэнергии, · повышенные капитальные и эксплуатационные затраты на охрану окружающей среды, В настоящее время считается, что расплавленные соли близки по своему строению к твердому веществу. Расплавленные соли при температурах, близких к температуре плавления, наследуют структуру твердого в-ва. Структура твердого кристалла характеризуется дальним порядком, т.е. правильным расположением частиц одна около другой во всем объеме кристалла.Но имеются разл дефекты.они увел-ся с увел-ем темп-ры,тем самым уменьшают дальний порядок.При переоде в жидкое сост-е дальний порядок полностью нар-ся,но созр ближний порядок.ряд солей имеют молекулярную стр-ру при их нагревании стр-ра сохр,расплав становится непроводящим.Для некоторых солей характерна слоистая стр-ра, в этом случае кристалл состоит из отдел-х пакетов.
Билет 1. ДЭС При соприкосновении двух фаз, имеющих заряженные частицы, возможен переход таких частиц в неэквивалентном количестве из фазы в фазу. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется так называемый двойной электрический слой (ДЭС), разность зарядов между обкладками которого, обуславливает скачок потенциала. Примером может служить поверхность раздела между металлом и водным раствором электролита. ДЭС может образовываться и без перехода заряженных частиц из фазы в фазу. В этом случае образование ДЭС возможно за счёт избирательной адсорбции ионов одной из фаз на поверхности другой. ДЭС может образоваться при адсорбции и ориентации полярных молекул жидкой фазы (например, воды) на поверхности твёрдого тела. Ме Меz+ + ze (A) окисление Ме Меz+ + ze (B) восстановление Скорости прямого и обратного процессов неодинаковы Скорость восстановления и окисления можно измерять плотностью тока реакция А i реакция B i По мере увеличения этих зарядов скорость реакции В будет уменьшаться, а скорость реакции А увеличиваться до наступления равновесия Билет 1 образ дэс на границе ме-эл-д.ме «+« На катоде могут протекать две реакции Ме Меz+ + ze (A) окисление Ме Меz+ + ze (B) восстановление Скорости прямого и обратного процессов неодинаковы Скорость восстановления и окисления можно измерять плотностью тока реакция А i реакция B i электрохимический потенциал катионов Ме в растворе выше, чем на поверхности Ме,.ТО в начальный момент скорость восстановления (В) будет выше, чем скорость окисления (А). начнется осаждение катионов ме.поверхность металла приобретает избыточный положительный заряд, а избыток анионов в растворе сообщает ему отрицательный заряд. По мере увеличения этих зарядов скорость осаждения будет уменьшаться, а скорость обратного растворения увеличиваться до наступления равновесия: 2. Химические цепи. В них источником электрической энергии является свободная энергия химической реакции, протекающей в электрохимической системе. Различают химические цепи с переносом, когда есть граница раздела между двумя растворами, и без переноса, когда такой границы нет. В качестве примера химической цепи с переносом можно привести цепь элемента Даниеля-Якоби Cu ç Zn ç ZnSO4 çç CuSO4 ç Cu Левый электрод обратим по отношению к ионам цинка, а правый – к ионам меди Zn + Cu2+ D Zn2+ + Cu E = E0 + RT/2F ln aCu2+/aZn2+ Примером химической цепи без переноса может служить стандартный элемент Вестона. Pt ç Cd (Hg) ç CdSO4 (нас. р-р) ç Hg2SO4, Hg ç Pt Левый электрод обратим по отношению к ионам кадмия Cd – 2e D Cd2+ а правый - к сульфат ионам Hg2SO4 + 2e D 2Hg + SO42- Билет 1.обр-е дэс на гран мет- эл-д.мет»-«. На катоде могут протекать две реакции Ме Меz+ + ze (A) окисление Ме Меz+ + ze (B) восстановление Скорости прямого и обратного процессов неодинаковы Скорость восстановления и окисления можно измерять плотностью тока реакция А i реакция B i Если электрохимический потенциал катионов Ме в металле выше, чем в электролите, то в начальный момент скорость окисления (А) будет выше, чем скорость восстановления (В). При этом поверхность металла приобретает избыточный отрицательный заряд, а раствор приобретает положительный заряд.возможно растворение катионов и обратное осаждение на пов-ти ме.К в р-ре обмен энергией м\ду собой с мол-ми р-ля.существует вероятность что катионы смогут преодолеть энергетический барьер и войти в состав крист реш ме.для 1-го К энергет барьер высок,по мере увел конц К у пов-ти уменш-ся. 2.влияние пав и комплексообраз-е. Добавки ПАВ изменяют перенапряжение и характер осадка. ПАВ способны увеличивать блеск осадка (блескообразователи), сглаживать их поверхность (выравниватели), изменять пористость, твёрдость, хрупкость и другие свойства. Обычно пав адсорбируютя в области опред потенциалов:1)орган в-ва адсорбируются в облатс потенц нулевого заряда2)пав катионного типа при потенциалах отрицательнее потенц н.з.3)пав анионного типа в области потенциалов положит потенц н.з. Обычно адсорбция пав происх избирательно тк разные грани кристаллов обладают разной поверх-й энергией.и там где в-ва адсорбировались происходит торможение электродного п-са-ингибирование.грани свободные от пав усиливают свой рост. Если осаждение идет из комплексных тэлектролитлов то как правило идет повышение перенапряжения,скорость переноса заряда уменьшается,осадки станоаятся мелкодисперсными.как правило разряд комплексных ионов сопр хим ре-ми.при разряде ме из комплекс-х ионов часто возник перенапр хим р-е Если неорганические или органические добавки образуют комплексные соединения с выделяющимся металлом, то равновесный потенциал смещается в отрицательную сторону за счёт уменьшения концентрации его свободных ионов. Подбирая соответствующие комплексообразователи можно изменить равновесные потенциалы ионов различных металлов так, чтобы обеспечить их совместный разряд или наоборот более полно разделить их. 3 осн закономерности анадного растворения. При анодном растворении потенциал металлов смещается в положит сторону,след перенапряж будет+..В области активного растворения выход атома металла из кристаллической решетки сопровождается определенными затруднениями, приводящими к фазовому перенапряжению,связанному с разрушением кристаллической решетки.При низких плотностях тока сопр электрохим перенапряж,при высоких-дифузионным перенапряж.Скорость и механизм анодного процесса растворения металла зависят от состава раствора. анионы могут измененять строение двойного слоя при их адсорбции и образованию комплексов с ионами ме.Изменение РН м/т привести к достижению РН гидр и след обр-ся нераствор гдроксиды на пов-ти ме,скорость пр-са ниж-ся.
Билет 10 Билет Билет 12 Знак эдс. Е = jп - jл. Следовательно, знак ЭДС устанавливается по положению потенциала правого электрода относительно левого и может быть как положительным, так и отрицательным. За направление тока принимают движение положит. зарядов ЭДС считается положительной, если при замыкании гальванического элемента на внешнее сопротивление электрический ток, за направление которого принимается движение положительных зарядов, течет в электролите (по внутренней цепи) от левого электрода к правому. (ЭДС «+») Электрохимический ряд напр. в 12ВОПРОСЕ (Можно отметить, что более отрицат. нах в окисленном состоянии и более активны,на катоде восст. более полож. элементы, все кто стоит до Н будут окисляться Н) 2электрохим восст-е мет.катодные р-и. катодные р-и: Mez+× x H2O + ze = Me + x H2O MeAx (z-x) + ze = Me + xA- Катодное выделение металла имеет ряд особенностей: 1. В ходе электролиза поверхность катода не постоянна, а непрерывно изменяется вследствие осаждения металла. Надо различать кажущуюся плотность тока, то есть силу тока на единицу геометрической видимой поверхности и истинную, то есть отношение силы тока к активной поверхности осадка. 2. Неустойчивость во времени потенциала катода. Изменения потенциала могут быть связаны с изменением активной поверхности катода (истинной плотностью тока), с изменением перенапряжения при осаждении металла. 3. Примеси ПАВ различных окислителей (например, растворённого кислорода) в электролите изменяют характер роста осадка, величину поляризации. 4. Наличие сопряжённых процессов, например, выделение водорода, изменяют рН раствора вблизи поверхности электрода, что может привести к гидролизу солей и влиять на ход электроосаждения металла.
При осаждении металла на инертном катоде зависимость поляризации от времени при постоянной силе тока может иметь следующий вид:
В нач потенц быстро сдвиг-ся в отриц сторону от равновесного знач,проходит ч/з макс(точ А) затем устанавл На некотором знач-и.После отключ тока(точВ) потенц приним равновесн знач.В(точ А) м/но увид обр-е зародыша.
Билет 13 1вольтамперные кривые в ус-ях диф-го перенапряж. дифф перенапряжение:
У-е даёт аналитическое выражение поляризационной зависимости для диффузионного перенапряжения.
При увеличении катодной плотности тока диффузионное перенапряжение будет плавно возрастать. При i®id перенапряжение hD®
2совместное восст-е двух мет. Если р-р электролита содержит катионы более электроплож ме-в чнм основной ме,то их совместный рзряд неизбежен.Если осн мет выдел с бол перенапряж то возможен разряд более электроотриц-х примесей чем осн ме.Пр-с осложняется обр-ем сплава на катоде при этом потенциал каждого ме + те обр-е сплава облегчает разряд катиона,тк уменьшается потенц энергия его компонентов и активоность ме в сплаве мен 1.
1-отраж пр-с восст осн мет 2-достигнута пред плотность тока,соответствует выдел ме2 в усл-ях пред плотности тока. Суммарная поляризационная---
Повышение электродной пол увел выход по току,тк скорость восст ме2 не м/т бол возр 3напряж разлож расплавленных солей. напряжение разложения-мин напряж,которое необходимо преложить из вне что бы происходил длит пр-с электролиза. Если эл-з происходит без перенапряж и поляризации,то напр разл=равновесн эдс.
Электроды сравнения:1)обратимые по отнош к катионам(метал эл-ды-ме погружен в расплав соли этого ме) 2) обрат по отнош к анионам(газовые:хлорный,кислородный) Билет 14 1. Окислительно-восстановительные электроды. В этих системах инертный металл электрода (Pt) является лишь передатчиком электронов между веществами Ox и Red. Например Fe3+ +e D Fe2+ j = j0Fe3+/Fe2+ +
Поясним эту связь для реакции окисления металлического железа до ионов Fe3+. Возможны 2 пути: непосредственное окисление Fe→Fe3+ и окисление через образование Fe2+.
Известно (следствие 1 закона термодинамики) что, если вещество переходит из состояния 1 в состояние 2 и это превращение происходит изотермически и обратимо, то изменение энергии Гиббса не зависит от пути перехода, а определяется только начальным и конечным состояниями. Следовательно, можно записать DG0Fe→Fe3+ = DG0Fe→Fe2+ + DG0Fe2+→Fe3+ DG0 = - zFj0 С помощью правила Лютера удаётся определить стандартные потенциалы и в более сложных случаях. 2. Электрокапиллярные явления отражают связь между поверхностным натяжением и потенциалом электрода. Изменение потенциала электрода (j) вследствие сообщения ему электрических зарядов от внешнего источника ЭДС (поляризация электродов) не должно сопровождаться процессами окисления или восстановления (фарадеевский процесс). Если электрические заряды, сообщаемые электроду, не будут расходоваться на протекание электродных реакций, то, оставаясь на электроде, они будут только изменять только его потенциал, изменяя соответственно только строение ДЭС. Такие электроды называются идеально поляризуемыми. Впервые электрокапиллярные явления были изучены на границе ртути и водных растворов электролитов Липпманом (1875), который использовал для этой цели сконструированный им капиллярный электрометр. Его исследования были продолжены Гуи, Фрумкиным, Батлером и др. Для ряда разбавленных растворов (например, H2SO4, KOH, KNO3, Na2SO4 и др.) форма электрокапиллярной кривой (ЭКК) почти не зависит от природы электролита и близка к параболе (рис.).
Увеличение поверхностного натяжения будет до тех пор, пока не будут нейтрализованы все ионы ртути, тогда поверхностное натяжение принимает максимальное значение σм. Потенциал, при котором σ = σм, называется потенциалом нулевого заряда jq=0. Дальнейшее сообщение отрицательного потенциала приводит к снижению поверхностного натяжения из-за отталкивания частиц, получивших отрицательный избыточный заряд. 3 катодное восст водорода. Электрохимическое восст. Н2 на поверхности рядя металлов протекает с очень большим перенапр.,выше чем в других электр. реакциях. Величина перенапряжения достигает 1В.Велечину перенапряжения можно изменить изменяя плотность тока, состава электролита,темпер.Во многих случаях технического применения эл-за водых р-в высокое перенапр вредно.При электроли получ ме-в за счет выс перенапр уменш кол-во элект-ва,которое расход на ненужное восст водорода 4стадии: 1)Стадия воосст водородного иона их кислого р-ра предст собой разряд катиона Н в щелочн р-х предполаг непосредствен присоединения электронов к молекулам воды с помлед их распадом Н2О+e=Надс +ОН- - щелочная среда 2) закл в образ водорода из адсорбир атомов.Надс +Н Надс +Н2О+e= +Н2+ ОН-- щелочная среда Любая из этих стадий м/т опред скорость всего пр-саэлектролит образ-я водорода и м/т бытьпоявлен водородного перенапряж. При удалении от равновесного потенциала поляризационная зависимость имеет ур. Тафеля: η=а+b lgi Билет 1 напряж на электролиз ванне. Количество электроэнергии, затраченное на получение единицы количества металла (или другого продукта электролиза).
Напряжение можно найти по закону Ома. Удельный расход электроэнергии-расход электроэнергии отнесен к массе получен пр-та при эл-зе 2механизм масса переноса. Перенос реагирующих веществ в условиях электрохимической реакции может осуществляться по трём механизмам. Первый механизм – молекулярная диффузия, то есть перемещение частиц вещества под действием градиента концентраци
|
|||||||||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 1046; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.012 с.) |

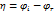
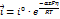



 . При сдвиге потенциала от равновесного знач ч/з эл-д протекает ток,равный разности частных токов.
. При сдвиге потенциала от равновесного знач ч/з эл-д протекает ток,равный разности частных токов.
 .Эти ур-я-ур-я полной поляризацион криво
.Эти ур-я-ур-я полной поляризацион криво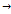 Mez+ n+1
Mez+ n+1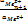 K(3)=
K(3)=  t=const растворимость Ме зависит от активности их соли,ионов высшей валентности в расплаве
t=const растворимость Ме зависит от активности их соли,ионов высшей валентности в расплаве ,
, 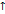 атомного радиуса
атомного радиуса 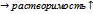 , + посторонних катионов
, + посторонних катионов  растворимость
растворимость  , σ
, σ 
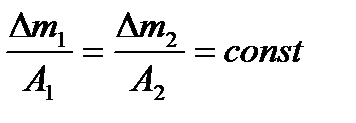
 , [г/А×с], [г/А×ч],
, [г/А×с], [г/А×ч],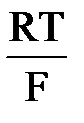 ln
ln 
 ln
ln 
 от С,Т.колл-е расчеты емкости дэс отл от оп-х данных.
от С,Т.колл-е расчеты емкости дэс отл от оп-х данных.

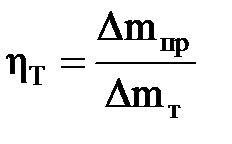


 - эффективный коэффициент диффузии электролита. Термин эффективный отражает то, что в действительности перемещение ионов происходит не только за счёт диффузии, но и под действием электрического поля (миграции).
- эффективный коэффициент диффузии электролита. Термин эффективный отражает то, что в действительности перемещение ионов происходит не только за счёт диффузии, но и под действием электрического поля (миграции).
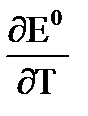
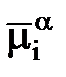 = mia ± ziFga;
= mia ± ziFga; 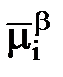



 . Для анодного процесса:
. Для анодного процесса: 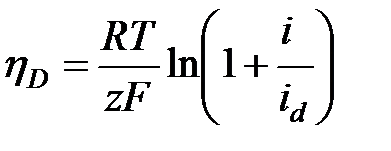 Ур-е показывает, что hD монотонно возрастает с повышением плотности тока.при анодном растворении металла на поляризационной кривой также появляется участок предельного тока, а иногда после достижения определённого потенциала, даже падение плотности тока. Одна из причин может быть то, что в реальных системах рост анодного тока ограничен насыщением раствора продуктами электролиза. Влияние миграции: часть ионов к поверхности электрода может доставляться не только диффузией, но и миграцией, т.е. под действием градиента электрического поля. Ионы переносят часть электрического тока. Число переноса: ti=Ii/I0, в сумме: ti=1. скорость, с которой будут двигаться ионы определяется скоростью миграции
Ур-е показывает, что hD монотонно возрастает с повышением плотности тока.при анодном растворении металла на поляризационной кривой также появляется участок предельного тока, а иногда после достижения определённого потенциала, даже падение плотности тока. Одна из причин может быть то, что в реальных системах рост анодного тока ограничен насыщением раствора продуктами электролиза. Влияние миграции: часть ионов к поверхности электрода может доставляться не только диффузией, но и миграцией, т.е. под действием градиента электрического поля. Ионы переносят часть электрического тока. Число переноса: ti=Ii/I0, в сумме: ti=1. скорость, с которой будут двигаться ионы определяется скоростью миграции 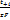 . Суммарная скорость диффузии миграции
. Суммарная скорость диффузии миграции 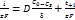 .
. 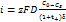
 для миграции. Миграция ускоряет доставку разряжающихся частиц к поверхности электрода. В этом случае числа переноса разряжающегося вещества становятся очень малыми.
для миграции. Миграция ускоряет доставку разряжающихся частиц к поверхности электрода. В этом случае числа переноса разряжающегося вещества становятся очень малыми. Стандартный потенциал простых окислительно-восстановительных электродов связаны со стандартными потенциалами электродов 1 рода. Поясним эту связь, которая называется правилом Лютера.
Стандартный потенциал простых окислительно-восстановительных электродов связаны со стандартными потенциалами электродов 1 рода. Поясним эту связь, которая называется правилом Лютера. Н2О+e=Надс +Н2О – кислая среда
Н2О+e=Надс +Н2О – кислая среда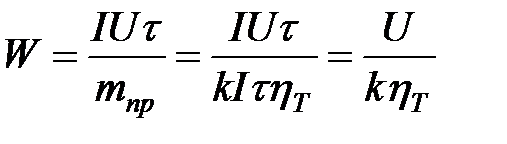 [кВт×ч/кг] U = Er + Eом + Djк + Djа U – напряжение на электролизной ванне, Er – равновесная ЭДС, Eом –омические падения напряжения во всех токоведущих частях электролизёра, Djк, Djа поляризация катода и анода.
[кВт×ч/кг] U = Er + Eом + Djк + Djа U – напряжение на электролизной ванне, Er – равновесная ЭДС, Eом –омические падения напряжения во всех токоведущих частях электролизёра, Djк, Djа поляризация катода и анода.


