
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция и ее характеристики. Теории полимолекулярной адсорбции.Содержание книги
Поиск на нашем сайте
Адсорбция – самопроизвольное перераспределение компонентов между поверхностным слоем и объемной фазой. Физическая адсорбция обусловлена действием физических сил притяжения – различными типами ван-дер-ваальсового взаимодействия. Обратима, является экзотермическим процессом (протекающим с выделением теплоты). Химическая адсорбция (хемосорбция) происходит за счет образования химических связей между молекулами (ионами, атомами) адсорбата и адсорбента. Хемосорбция обычно необратима. Поглощающее (адсорбирующее) вещество называют адсорбентом, а поглощающееся (адсорбирующееся) – адсорбатом. Для количественной характеристики адсорбции используются две величины: 1.удельная (гиббсовская) адсорбция Гi: Т. е. гиббсовская адсорбция – это избыток вещества в межфазном поверхностном слое, приходящийся на единицу площади поверхности по сравнению с количеством вещества в таком же объеме фазы.
2.полная адсорбция аi. Полная адсорбция – количество вещества в поверхностном слое толщиной δ в расчете на единицу поверхности или массы адсорбента: Между Гi и аi существует взаимосвязь: Гi может быть больше и меньше 0. При адсорбции в условиях Т ‹ Ткр имеет место конденсация, и мономолекулярный слой не компенсирует поверхностную энергию è образуется несколько адсорбционных слоев (полимолекулярная адсорбция). Полимолекулярная адсорбция реализуется в двух случаях:
Для первого случая была предложена потенциальная теория адсорбции Поляни, которая дает термодинамическое описание процесса адсорбции. Теория Поляни Основные постулаты:
где Vm – молярный объем адсорбата в конденсированном состоянии. У поверхности действует поле адсорбционных сил, интенсивность которых уменьшается с расстоянием. Для характеристики интенсивности поля введен адсорбционный потенциал ε. Физический смысл ε – это изотермическая работа по переносу 1 моль пара адсорбата из достаточно удаленного от поверхности объема в адсорбционный объем. или это изотермическая работа по сжатию адсорбата от давления р до давления насыщения рs.
где рs – давление насыщенного пара адсорбата в отсутствие адсорбента; р – равновесное давление, т.е. давление пара адсорбата в присутствии адсорбента.
- потенциальная характеристическая кривая данного адсорбента
Для данного адсорбента и адсорбата, зная изотерму адсорбции при данной температуре Т1, можно рассчитать изотерму для другой температуры Т2. Рассчитаем а2 и р2 для другой температуры:
Важная особенность потенциальных кривых была обнаружена Дубининым. Она заключается в том, что характеристические кривые для одного и того же объема адсорбента и разных адсорбатов при всех значениях объемов адсорбата в поверхностном слое находятся в постоянном отношении β: Для данного адсорбента, имея β и зная изотерму адсорбции, можно рассчитать изотерму любого другого адсорбата на данном адсорбенте. D Эта теория не дает уравнения изотермы адсорбции, только термодинамическое описание. Для второго случая используют теорию БЭТ (теория Брунауэра, Эммета и Теллера). Теория БЭТ. Согласно этой теории каждый адсорбционный центр sх связывает несколько молекул адсорбента Х, образуя цепочки: Уравнение, описывающее адсорбцию, выглядит следующим образом:
D Это уравнение работает только в интервале При При C теория имеет практическое значение, т. к. можно определить удельную поверхность адсорбента. Величина а∞ зависит от энергетической равноценности поверхности и наличия пор. Для характеристики адсорбента используется понятие «пористость» П:
|
|||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 406; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.234.146 (0.01 с.) |

 , где ni – количество вещества в реальной системе;
, где ni – количество вещества в реальной системе;  – в фазе I,
– в фазе I, 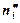 – в фазе II идеальной системы, s – площадь межфазной поверхности.
– в фазе II идеальной системы, s – площадь межфазной поверхности. , где – толщина поверхностного слоя,
, где – толщина поверхностного слоя, [ кг/м2 ], либо [ моль/кг ], либо [ кг/кг ].
[ кг/м2 ], либо [ моль/кг ], либо [ кг/кг ].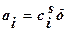
 , аi всегда больше0
, аi всегда больше0
 все адсорбированное вещество находится в конденсированном состоянии;
все адсорбированное вещество находится в конденсированном состоянии; ,
, ,
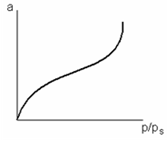
, Каждой точке изотермы адсорбции соответствуют определенные значения а и р/рs, которые позволяют получить значения V и ε, т. е. найти зависимость адсорбционного потенциала от объема адсорбата на адсорбенте – потенциальную кривую адсорбции.
Каждой точке изотермы адсорбции соответствуют определенные значения а и р/рs, которые позволяют получить значения V и ε, т. е. найти зависимость адсорбционного потенциала от объема адсорбата на адсорбенте – потенциальную кривую адсорбции.
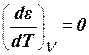 , т. е. адсорбционный потенциал от температуры не зависит.
, т. е. адсорбционный потенциал от температуры не зависит. .
. ,
, 
 ê
ê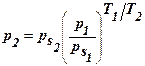
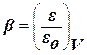 ,где β – коэффициент аффинности, ε – адсорбционный потенциал для одного адсорбата, εо – для другого.
,где β – коэффициент аффинности, ε – адсорбционный потенциал для одного адсорбата, εо – для другого.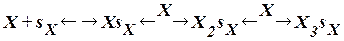
 , где
, где  ; Кр – константа адсорбции; КL – константа конденсации.
; Кр – константа адсорбции; КL – константа конденсации. Для нахождения констант этого уравнения на основании экспериментальных данных строят график:
Для нахождения констант этого уравнения на основании экспериментальных данных строят график: 
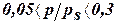 , в котором предполагается отсутствие взаимодействия между цепочками адсорбированных молекул.
, в котором предполагается отсутствие взаимодействия между цепочками адсорбированных молекул.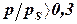 – большая степень заполнения, возникают боковые взаимодействия между молекулами.
– большая степень заполнения, возникают боковые взаимодействия между молекулами. – малая степень заполнения, на величину адсорбции сильно влияют энергетические неоднородности поверхности.
– малая степень заполнения, на величину адсорбции сильно влияют энергетические неоднородности поверхности. , где sо – площадь, занимаемая молекулой адсорбата.
, где sо – площадь, занимаемая молекулой адсорбата.



