
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изобразите изотермы поверхностного натяжения водных растворов метиламина и пропиламина и покажите, как от них можно перейти к изотермам адсорбции. Изобразите изотермы адсорбции этих веществ.Содержание книги
Поиск на нашем сайте
В гомологическом ряду нормальных жирных кислот, спиртов, аминов и т.д., поверхностная активность по отношению к воде резко возрастает на каждую группу СН2. Количественной мерой поверхностной активности служит величина g: Адсорбция – это изменение концентрации компонента в поверхностном слое по сравнению с объёмной фазой, отнесённое к единице площади поверхности; самопроизвольное перераспределение компонентов системы между повехностным слоем и объёмной фазой. Уравнение, связывающее адсорбцию с изменением поверхностного натяжения: a- адсорбция, с – концентр растворённого вещества.
4. Как различаются осмотические давления апельсинового сока а) с мякотью, б) без мякоти. Ответ обоснуйте Если считать концентрацию дисперсной фазы в соке с мякотью и без мякоти одинаковой, то осмотическое давление с мякотью будет меньше, чем без мякоти.
Для коллоидных систем можно записать: Частичная или численная концентрация – это число отдельных частиц в единице объема дисперсной системы: Связь с массой и размерами частиц такова: т. к. Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор). 5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А – CaCl2, В - H2SO4, С - CaSO4 Реакция: CaCl2+ H2SO4 = CaSO4 + 2HCl В первом случае(избыток А): {m[CaSO4]nCa2+2(n-x)Cl-}2x+2xCl- В избытке B: {m[CaSO4]nSO42-2(n-x)H+}2x-2xH+ 6. Пороги коагуляции золя Cu(OH)2 для электролитов Na2SO4 и BaCl2 соответственно равны 0.04 и 0.004 моль/л. Определите заряд колоидной частицы и запишите структурную формулу мицеллы гидрозоля. Изобразите графически как изменится ζ-потенциал при добавлении к такому гидрозолю NaOH. Мицелла гидрозоля: {m[Cu(OH)2]nOH-(n-x)H+}x-xH+ Порог коагуляции однозарядного иона (порог 1) и двухзарядного иона (порог 2) в соответствии с эмпирическим правилом Шульце – Гарди должны приблизительно соотноситься: порог1: порог2 = 500: 25 = 20: 1. Пороги коагуляции Na2SO4 и BaCl2 соотносятся 0,04: 0,004 = 10: 1. Следовательно, в соединении Na2SO4 коагуляцию вызывает однозарядный ион (Na+), в соединении BaCl2 – двузарядный ион (Ba2+). Значит коагуляция вызывается катионами, а заряд коллоидной частицы имеет отрицательный знак.
Билет 7 Изотерма адсорбции Лэнгмюра. В области высоких концентраций закон Генри не соблюдается, но можно использовать уравнение Ленгмюра (изотерму адсорбции Лэнгмюра):
где а∞ – предельная адсорбция (адсорбция при предельном заполнении поверхности монослоем), к – константа, с – общая концентрация ПАВ в растворе. Вывод данного уравнения основан на описании адсорбции формальным химическим уравнением:
где Х – молекула ПАВ в объемной фазе; sХ – свободный участок поверхности; ХsХ – «комплекс» молекулы с соответствующим участком поверхности. Динамическое равновесие, устанавливающееся между поверхностным слоем и объемной фазой в отношении растворенного вещества характеризуется константой адсорбции:
Величина адсорбции равна:
где Y – степень насыщения поверхности веществом Х (доля участков sХ, занятых веществом). Получаем:
Чтобы перейти к уравнению Ленгмюра, надо заменить [Х ] на с (общую концентрацию ПАВ в растворе):
а∞ и к можно найти графически: Преобразуем уравнение Ленгмюра к такому виду:
1 /с = −к.
|
|||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 365; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.74.120 (0.01 с.) |

 Правило Дюкло-Траубе:
Правило Дюкло-Траубе: )p,T
)p,T

 ,где с – молярность раствора, моль/м3, П – осмотическое давление.
,где с – молярность раствора, моль/м3, П – осмотическое давление.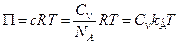 .
. . где V0 – общий объем дисперсной системы, Nч – число частиц дисперсной фазы.
. где V0 – общий объем дисперсной системы, Nч – число частиц дисперсной фазы. , то
, то  , где mДФ и mч – это масса всех частиц дисперсной фазы и одной частицы соответственно. Таким образом, при одной и той же массовой доле частичная концентрация тем меньше, чем крупнее частицы.
, где mДФ и mч – это масса всех частиц дисперсной фазы и одной частицы соответственно. Таким образом, при одной и той же массовой доле частичная концентрация тем меньше, чем крупнее частицы.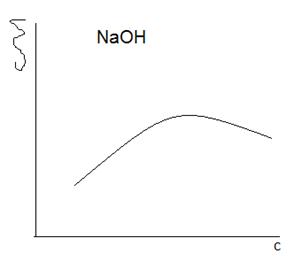






 Принцип независимости поверхностного действия: в гомологических рядах различных ПАВ (спиртов, аминов, кислот и др.) предельное значение адсорбции для всех членов одинаково, т. е. не зависят от длины углеводородного радикала. При предельном заполнении поверхностного слоя возможен только один вариант расположения молекул – частокол Ленгмюра.
Принцип независимости поверхностного действия: в гомологических рядах различных ПАВ (спиртов, аминов, кислот и др.) предельное значение адсорбции для всех членов одинаково, т. е. не зависят от длины углеводородного радикала. При предельном заполнении поверхностного слоя возможен только один вариант расположения молекул – частокол Ленгмюра.




