
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Конденсационные методы получения лиофобных дисперсных систем.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Билет №1 Конденсационные методы получения лиофобных дисперсных систем. К лиофобным относятся колл. системы, в которых частицы ДФ слабо взаимодействуют с ДС. Эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов. Методы получения колл. растворов можно разделить на две группы: методы конденсации и диспергирования (в отд. группу выделяется метод пептизации). Конденсация – метод получения дисп. систем, в основе которого лежит процесс укрупнения мельчайших частиц ДФ (молекулярных размеров) до частиц с размерами определённого класса дисп. систем. В-во, находящееся в молекулярно-дисп. состоянии, можно перевести в колл. состояние при замене одного растворителя другим – т.н. методом замены растворителя. Пример: Канифоль не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется гидрозоль канифоли. Колл. растворы можно получать также и методом химической конденсации, основанном на проведении хим. реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золотой кислоты формальдегидом: NaAuO2 + HCOH + Na2CO3 → Au(колл.) + HCOONa + H2O Золи могут быть получены по реакциям ионного обмена, в результате которых выделяется нерастворимая соль, образующая при определенных условиях коллоидный раствор. Так можно получить золь AgI: AgNO3 + KI → AgI(золь) + KNO3 Процесс гидролиза различных солей может приводить к образованию коллоидных растворов нерастворимых гидроксидов или кислот. Так получают, например, золь гидроксида железа(III), имеющий следующее строение: FeCl3 + H2O → {[Fe(OH)3]m · n FeO+ · (n–x)Cl–}x+ · x Cl– Также лиофобных дисп. системы могут образовываться путём конденсации пересыщенного пара. Особенности адсорбции ионов и молекул из растворов на твердой поверхности. В зависимости от вида адсорбируемых частиц различают молекулярную и ионную адсорбции.
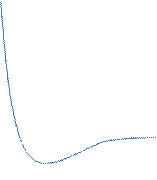
· В системе полярный адсорбент – неполярный растворитель амфифильные молекулы ориентируются полярной головкой к поверхности адсорбента, а неполярным хвостом – к растворителю. В системе неполярный адсорбент–полярный растворитель ориентация, очевидно, обратная. · На полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей, на неполярных же адсорбентах – неполярные вещества из полярных растворителей. · Чем лучше в данном растворителе растворяется адсорбат, тем он хуже адсорбируется, и наоборот: чем хуже он растворяется – тем лучше адсорбируется. · Если происходит адсорбция из разбавленных растворов, то в гомологических рядах она увеличивается с ростом молекулярной массы адсорбата. · Правило Дюкло – Траубе соблюдается только до определенной длины молекулы, а далее адсорбция может уменьшаться. · Как правило, с увеличением температуры адсорбция уменьшается за исключением того случая, когда вещество плохо растворяется (с увеличением температуры увеличится растворимость а следовательно, и адсорбция). · Процесс адсорбции идет в сторону выравнивания полярностей и тем интенсивнее, чем больше разность полярностей – правило уравнивания полярностей Ребиндера. Полярность адсорбата должна быть промежуточной между полярностью среды и адсорбента. Реология Реология - это наука, формулирующая правила и законы обобщённого рассмотрения механического поведения твёрдо- и жидкообразных тел. Основным методом реологии является рассмотрение механ. свойств на конкретных идеальных моделях. Объектами реологии являются полимеры (расплавы, р-ры), дисперсные системы (пены, эмульсии, суспензии, порошки, пасты), металлы и сплавы, нефтепродукты и т.д. Полная реологическая кривая мало концентрированной дисперсной системы с анизометричными частицами:
τ – скорость течения (напряжение сдвига) ηэф = τ/γ
Пояснение: При малых скоростях деформации эффективная вязкость максимальна, затем она постепенно падает до некоторого максимального значения, не изменяющегося при дальнейшем увеличении скорости и соответствующего течению системы с полностью ориентированными в потоке частицами.
Билет 2 Как влияет температура на термодинамические функции поверхностного слоя в однокомпонентных жидкостях на границе с собственным паром? Как экспериментально можно определить полную поверхностную энергию жидкости? При постоянной температуре и давлении поверхностная энергия Гиббса определяется произведением поверхностного натяжения (фактор интенсивности) s на площадь поверхности (фактор емкости ) s: GS=σs
где – V – объем дисперсной фазы, мл; k – коэффициент формы частиц; d -диаметр частицы, м2.
Поверхностное натяжение можно представить как энергию переноса молекул из объема тела на поверхность или как работу образования единицы поверхности. Поверхностное натяжение можно выразить частной производной от энергии Гиббса по величине межфазной поверхности при p и T=const (при постоянных числах молей компонентов):
Поверхностное натяжение жидкости, как и другие ее свойства, связанные с тепловым движением молекул, зависит от температуры. В самом деле, с повышением температуры увеличивается интенсивность теплового движения молекул, вследствие чего межмолекулярные силы ослабевают, и поверхностное натяжение падает. Поэтому температурный коэффициент чистой жидкости
где К и а – постоянные величины, зависящие от природы жидкости; Т кр – критическая температура; Т – температура опыта. Экспериментальные данные свидетельствуют, что при приближении температуры к Т кр наблюдаются отклонения от линейной зависимости s от Т. Рассмотрим опыт Дюпре: На проволочной рамке образуем мыльную пленку. Нижняя сторона рамки – подвижная и, если ничем не нагружена, поднимается вверх из-за стремления пленки сократиться, т. е. На рамку действует сила поверхностного натяжения Fп. Эту силу можно уравновесить грузиком весом Р = Fп. При увеличении веса груза на бесконечно малую величину происходит перемещение подвижной стороны рамки на dh Груз при этом совершает работу против силы Fп: Одновременно из-за увеличения поверхности пленки возрастает поверхностная энергия: Так как Таким образом, величина σ может рассматриваться не только как удельная поверхностная энергия, но и как сила, отнесенная к единице длины контура, ограничивающего поверхность. 4. Почему бумага впитывает воду, а плащевая ткань не промокает? Какое коллоидно-химическое явление лежит в основе этих процессов? Охарактеризуйте его. Плащевая ткань может иметь следующий состав: полиэфир 100%, полиэфир + хлопок, полиамид + хлопок, полиэфир + вискоза. Содержание хлопка или вискозы приближает ее по гигиеническим показателям к натуральным тканям, сохраняя при этом лучшие свойства синтетики. Изделия из смесовых тканей могут иметь масловодоотталкивающую пропитку, которая придает ткани высокие масло- и грязеотталкивающие свойства. Щелочная отварка является основной операцией процесса подготовки хлопчатобумажных тканей. Назначение этого процесса заключается в удалении природных примесей целлюлозы, а также примесей, нанесенных на волокно в прядении и ткачестве. Одновременно с этим необходимо обеспечить равномерную и высокую смачивающую и сорбционную способность при максимальном сохранении исходных физико-механических свойств хлопкового волокна. Это достигается в результате происходящих при отварке сложных физических, химических и коллоидно-химических процессов, таких как адсорбция, диффузия, набухание, растворение, эмульгирование, гидролиз и окисление.
Эффективное удаление примесей целлюлозы и получение высокой капиллярности достигается лишь при горячих щелочных обработках. Гидрофобные свойства хлопка обусловлены наличием на наружной поверхности волокна пектиновых, азотсодержащих (белковых) и воскообразных примесей. В процессе отварки в волокне протекают следующие химические процессы. Пектиновые вещества под действием щелочи при высокой температуре гидролизуются с образованием водорастворимых продуктов (пентозы, гексозы и др.) Белковые соединения в щелочной среде гидролизуются, а образующиеся натриевые соли аминокислот не только способны переходить в раствор, но и являются хорошими эмульгаторами, способствующими интенсивному удалению воскообразных веществ и других загрязнений с поверхности волокна. Воскообразные примеси, представляющие собой сложные эфиры высших кислот с жирными спиртами, частично гидролизуются под действием щелочи:
Выделяющиеся при этом, хотя и в незначительном количестве, жирные кислоты (пальмитиновая, стеариновая, олеиновая) под влиянием щелочи образуют натриевые соли – мыла, обладающие высокой поверхностной активностью, хорошей растворимостью в воде и высокой эмульгирующей способностью. Такие вещества называют поверхностно-активными (ПАВ), поскольку они способны снижать поверхностное натяжение на поверхности раздела фаз «варочная жидкость – воскообразные частицы». Молекулы ПАВ своими гидрофобными концами вступают в контакт с воскообразными примесями и полярными гидрофильными группами ориентируются в сторону варочного раствора. При этом расплавленная капля воска стягивается по периметру, превращаясь в шарообразную микрокаплю, удерживаемую поверхностью волокна в одной точке как это показано на рис.1.
волокно Рис.1. Механизм эмульгирования воскообразных примесей Эмульгированные поверхностно-активными веществами воскообразные частицы отрываются от поверхности волокна и переходят в раствор, образуя устойчивую эмульсионную систему. Путем омыления жировых веществ удаляется около 40% воскообразных примесей, остальные выводят из волокна введением в варочную жидкость дополнительного количества ПАВ. Последние должны обладать не только поверхностно-активными свойствами, но и высокой эмульгирующей способностью, то есть не вызывать слипания частиц и расслаивания эмульсии. ПАВ должны биологически расщепляться в сточных водах, обладать устойчивостью к действию высоких температур и быть сравнительно недорогими.
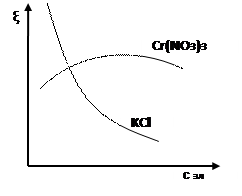
Экстрагированные из волокна примеси и образующиеся при отварке осадки гидроксидов металлов должны удерживаться в растворе и повторно не сорбироваться волокном. Минеральные вещества, сопутствующие целлюлозе, при взаимодействии со щёлочью образуют гидраты, растворимые в воде, и удаляются при промывке. В процессе отварки не исключена возможность каталитического окисления целлюлозы активным кислородом, так как при высокой температуре обработки кислород воздуха в присутствии щелочей образует перекисные соединения. Последние взаимодействуют с целлюлозой, в результате чего получается оксицеллюлоза. Об этом свидетельствует снижение вязкости медно-аммиачных растворов целлюлозы в процессе варки. Данные теоретические предпосылки учитываются при реализации процесса отварки на практике. Так в состав варочной жидкости кроме гидроксида натрия (основного компонента, разрушающего практически все примеси) и ПАВ дополнительно вводят силикат натрия – Na2SiO3 и восстановители (традиционно бисульфит натрия – NaHSO3). Силикат натрия адсорбирует продукты распада естественных примесей целлюлозы и тем самым устраняет возможность их повторного осаждения на волокно. Кроме того, он выступает в качестве защитного средства, препятствующего образованию на ткани осадков гидроксидов металлов в виде ржавых пятен. Последние образуются в варочной жидкости из компонентов, содержащихся в воде – солей железа, солей жёсткости и др. – в виде устойчивых коллоидных гидрозолей. Силикат натрия коагулирует их, превращая в грубодисперсные частицы, не способные сорбироваться волокном. Восстановители в составе варочной жидкости выполняют две функции: защищают целлюлозу от окисляющего действия кислорода воздуха и способствуют удалению лигнина, содержащегося в механических примесях в виде «галочек». Помимо бисульфита натрия, в условиях непрерывных процессов отварки при высоких концентрациях щёлочи, в качестве восстановителей рекомендуют использовать ронгалит, диоксид тиомочевины, тиомочевину, сульфид натрия, а в последние годы – антрахинон и его производные. 5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А - Na2 SiO3, В - HCl, С - H2SiO3 При избытке HCl: { m (H2SiO3) nH+ (n -x)Cl- }х+ хCl- При избытке Na2SiO3: { m (H2SiO3) nSiO32- 2(n -x)Na+ }2х- 2х Na+ 6. Определите тип электролитов: KNO3, NaOH, Cr(NO3)3 по отношению к золю Cr(OН)3 (стабилизатор CrCl3). Проиллюстрируйте графически, как влияет на величину ζ-потенциала добавление к золю растворов Cr(NO3)3, KCl.
KNO3- индеферентный, NaOH- неиндеферентный, Cr(NO3)3 – неиндеферентный
Cr(NO3)3 Если один из ионов электролита способен достраивать кристаллическую решетку коллоидной частицы, то он повышает ζ-потенциал. Находящийся с ним в паре ион, одинаковый по знаку с зарядом противоионов, способен сжимать ДЭС. При малых концентрациях действует первый фактор. При больших концентрациях, когда достройка кристаллической решетки завершена, превалирует второй фак- тор. Поэтому при введении в систему неиндифферентного электролита ζ-потенциал сначала будет возрастать, а потом падать, проходя через максимум. КCl - Увеличивает ионную силу.
Билет 4 1. Смачивание и растекание: В гетерогенных системах различают два типа межмолекулярного взаимодействия: внутрифазное и межфазное. Притяжение атомов и молекул внутри отдельной фазы называют когезией. Именно она определяет возможность существования веществ в конденсированном состоянии. К межфазным взаимодействиям относятся понятия адгезии, смачивания и растекания. Адгезия (прилипание) – взаимодействие между приведенными в контакт поверхностями конденсированных фаз разной природы. Адгезия обеспечивается физическими или химическими силами взаимодействия. Смачивание и растекание – это адгезионные взаимодействия между жидким и твердым телом. Явления адгезии и смачивания широко распространены в природе и технологических процессах: склеивание различных материалов, нанесение лаков, красок, металлических покрытий, печать, крашение тканей, изготовление различных материалов на основе связующих веществ.
Схема, иллюстрирующая понятия когезии (а) и адгезии (б). Количественные характеристики адгезионных процессов: Чтобы разорвать столбик жидкости с образованием двух новых поверхностей раздела (см. схему а), необходимо затратить работу, которая равна работе когезии, но противоположна по знаку: W разр = –W к; W к = 2σ12. Изменение энергии Гиббса в этом процессе: ∆ G к = ∆ G кон – ∆ G нач = σ12 + σ12 – 0 = 2σ12; W разр = – ∆ G к. Работа, затрачиваемая на разрыв поверхностного слоя на схеме б будет равна работе адгезии с обратным знаком: W разр = –W а = – ∆ G а, где ∆ G – изменение энергии Гиббса в процессе разрушения адгезионного слоя. Изменение энергии Гиббса в этом процессе: ∆ G нач = σ13; ∆ G кон = σ32 + σ12 – σ13; ∆ G а = ∆ G кон – ∆ G нач = σ32 + σ12 – σ13; W а = σ32 + σ12 – σ13 – уравнение Дюпре. Закон Юнга. Уравнение, выражающее взаимосвязь работы когезии, поверхностного натяжения и краевого угла смачивания. Это уравнение называется уравнением Юнга-Дюпре:
Оно позволяет выразить термодинамические условия смачивания через соотношения работ когезии и адгезии. Несмачиванию отвечает условие ½ W а < W к, смачиванию ½ W к < W а < W к, растеканию жидкости по твердому телу W а > W к закономерности смачивания выполняются не на всех поверхностях, а только на идеально гладких и однородных. Реально же твердые тела всегда имеют неоднородности, от которых зависит краевой угол смачивания, и которые затрудняют определение краевых углов. Билет 5 Осадок образовался в результате коагуляции гидрозоля ZnS. Напишите формулу частиц осадка, если известно, что промывание его водой приводит к получению коллоидного раствора с положительно заряженными частицами. Назовите метод получения гидрозоля и запишите его схему. В данном случае используют метод химической конденсации. Он основан на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Для этой цели используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. В этом случае – гидролиз. Реакция: ZnS + H2O = H2S + ZnO Формула полученной мицеллы: {m[Zn(OH)2] nZn2+ (n - x) S2-}2x+ * xS2-}
Билет 6 Билет 7 Замечено, что сливочное масло взбивается легче из постоявшей сметаны, чем из свежей. Дайте объяснение этому явлению с коллоидно-химической точки зрения, учитывая также и некоторое прокисание сметаны при стоянии. Сливочное масло — пищевой продукт, получаемый из сливок. Представляет собой эмульсию, в которой капельки воды являются дисперсной фазой, а жир - дисперсионной средой (в отличие от сливок, где жир является дисперсной фазой, а вода - дисперсионной средой). У постоявшей сметаны уменьшается агрегативная устойчивость и частички жира легче и быстрее слипаются, следовательно, когда взбивают сметану, ускоряют процесс слипания частиц. Прокисание сметаны также приводит к уменьшению агрегативной устойчивости. 5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А - CaCl2, В - H2SO4, С - CaSO4 Реакция: CaCl2+ H2SO4 = CaSO4 + 2HCl В первом случае(избыток А): {m[CaSO4]nCa2+2(n-x)Cl-}2x+2xCl- В избытке B: {m[CaSO4]nSO42-2(n-x)H+}2x-2xH+ 6. Имеются электролиты K2SO4, NaNO3, Ca(NO3)2, способные вызвать коагуляцию золя, полученного при взаимодействии избытка KBr с AgNO3. Как соотносятся пороги коагуляции данного золя, этими электролитами? Изобразите графически как изменяется ζ-потенциал при увеличении концентрации каждого из электролитов. KBrизб+AgNO3=AgBr↓+KNO3 {[mAgBr]nBr-(n-x)K+}x-xK+ Порог коагуляции:
Билет 8. Какое отношение имеет минерал «драгоценный опал» к коллоидной химии? Для коллоидной химии опал- это дисперсии, обладающие анизотропными областями с хорошо выраженной периодичностью в расположении ориентированных относительно друг друга коллоидных частиц. Опал SiО2•nН2О – типичный твердый минеральный гель.Характерно проявление опалесценции — известный эффект Тиндаля: при прохождении светового пучка сквозь мутную среду со взвешенными частицами, размер которых составляет 0,1—0,2 длины волны падающего света, при взгляде сбоку на темном фоне появляется светлый (голубоватый) конус — так называемый "конус Тиндаля" 5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А - K3(Fe(CN)6), В - AgNO3, С - Ag3(Fe(CN)6) K3(Fe(CN)6)+ 3 AgNO3 = Ag3(Fe(CN)6) ↓ + 3 KNO3 1.Пусть в избытке K3(Fe(CN)6) {m[Ag3(Fe(CN)6)]n*Fe(CN)63-*3(n-x)K+}3x-*3xK+. 2. Пусть в избытке AgNO3 {m[Ag3(Fe(CN)6)]n*Ag+(n-x)* NO3-}x+*xNO3-. 6. Изобразите графически изменение ζ-потенциала для золя MnO2 (стабилизатор Na2S2O3) при добавлении к нему электролитов NaCl, AgNO3, KMnO4, Na2S2O3. Этот золь получают по уравнению: 8KMnO4 +3 Na2S2O3+ Н2О = MnO2↓+ К2SO4+КОН + 3 Na2SO4.

       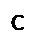
Если вносимые в систему электролиты являются индифферентными – не содержат таких ионов, которые были бы способны к специфической адсорбции на частицах по правилу Панета-Фаянса. Тогда повышение ионной силы оказывает двойное действие: уменьшение толщины диффузного слоя противоионов (d), сдвиг противоионов между плотным и диффузным слоями в сторону плотного слоя (уменьшение х – заряда частиц). И то, и другое приводит к снижению -потенциала. Если это снижение достаточно сильное, дисперсные частицы начинают коагулировать. Коагуляция – важный процесс, и требует отдельного рассмотрения. Здесь же упомянем очевидное правило Шульце-Гарди: - коагулирующим действием обладают ионы, заряженные противоположно заряду частицы; - сила коагулирующего действия возрастает с увеличением заряда ионов; - при одинаковом заряде ионов коагулирующее действие возрастает с увеличением радиуса иона.
Билет 9. 1. Зависимость поверхностного натяжения от концентрации ПАВ. Уравнение Шишковского, физический смысл его констант и методы их определения.
Математическое описание зависимости σ( С ) дает уравнение Шишковского, полученное экспериментально при исследовании водных растворов жирных кислот: Приравняем выражения для ленгмюровской и гиббсовской адсорбций, что вполне справедливо для разбавленных растворов:
Разделим переменные и проинтегрируем:
Образование и строение двойного электрического слоя на границе раздела фаз. ДЭС – важнейший фактор, обеспечивающий агрегативную устойчивость дисперсных систем. В коллоидных системах он возникает в результате адсорбции ионов на поверхности частиц дисперсной фазы или диссоциации расположенных на поверхности функциональных групп и представляет собой систему пространственно разделенных зарядов противоположного знака на межфазной поверхности. В простейшем варианте его можно рассматривать как своеобразный конденсатор, обкладки которого состоят из противоположных по знаку зарядов, т. е. ДЭС – слой ионов одного знака + слой ионов второго знака (по теории Гельмгольца –Перрена). Различают адсорбцию ионов: избирательную и обменную. Избирательная адсорбция регулируется правилом Фаянса –Панета: На поверхности твердого тела, в том числе частицах дисперсной фазы, преимущественно адсорбируются те ионы, которые а) способны достраивать кристаллическую решетку твердого тела и об-разовывать с ионами, входящими в ее состав, нерастворимые соединения; б) присутствуют в растворе в избытке. Кроме того, могут адсорбироваться и изоморфные (близкие по структуре и размерам) с данной кристаллической Для объяснения строения ДЭС были предложены 3 теории: 1. График зависимости ψ(х) имеет вид:
Недостатки теории: –было установлено, что граница скольжения расположена от поверхности на большем расстоянии, чем молекулярные размеры; –согласно этой теории ζ = φ, но экспериментально установлено, что ζ < φ;
2. Теория Гуи – Чепмена. На твердой поверхности адсорбируются ионы определенного знака и, помимо электростатических сил, на их распределение влияет тепловое движение. Вследствие этого слой противоионов размыт. Распределение в нем зарядов подчиняется закону Больцмана: Достоинства теории: & ζ-потенциал рассматривается как часть φ-потенциала; & позволила понять действие индифферентных электролитов на ζ-потенциал.
–не учитываются размеры ионов, они рассматриваются как точечные заряды; –не объясняется явление перезарядки; –согласно этой теории различные ионы одинакового заряда должны одинаково сжимать ДЭС и снижать ζ-потенциал, но реально этого нет: чем больше радиус иона, тем сильнее он сжимает ДЭС и понижает ζ-потенциал. Работает только для разбавленных растворов. 3. Теория Штерна. Штерн объединил две предыдущие теории. Согласно его теории ионы – не точечные заряды, они имеют размеры и не могут находиться на расстоянии от поверхности меньшем, чем радиус иона. Помимо электростатического взаимодействия с твердой поверхностью существует специфическое адсорбционное. Эти силы действуют на небольших расстояниях, имеют адсорбционную природу и убывают с расстоянием быстрее, чем электростатические. Согласно этой теории существует два слоя противоионов: 1-й – адсорбционный слой (слой Гельмгольца, Штерна). Он удерживается на твердой поверхности электростатическими и адсорбционными силами; противоионы адсорбционного слоя равномерно распределены в слое, поэтому падение потенциала происходит линейно. 2-й – диффузный слой (слой Гуи). Это размытый за счет теплового движения слой оставшихся противоионов, который удерживается только электростатическими силами; его толщина – δ, он образуется теми противоионами, которые находятся на заряженной поверхности на расстоянии, большем, чем диаметр гидратированного противоиона d, но в пределах расстояния δ. Эти противоионы притягиваются к частице только за счет электростатических сил, а следовательно, менее прочно, чем противоионы адсорбционного слоя. При движении частицы двойной электрический слой разрывается. Место разрыва при перемещении твердой и жидкой фаз друг относительно друга называется плоскостью скольжения. На рисунке плоскость скольжения обозначается пунктирной линией. Плоскость скольжения лежит либо на границе между диффузным и адсорбционным слоями, либо в диффузном слое, но вблизи этой границы. Потенциал на плоскости скольжения называется электрокинетическим или ζ-потенциалом. Электрокинетический потенциал является важнейшей характеристикой ДЭС. Согласно этой теории при введении электролитов в систему ионы из диффузионного слоя переходят в адсорбционный слой из-за чего ζ-потенциал уменьшается и может достичь нуля. При разбавлении системы ζ-потенциал увеличивается. На размер ДЭС сильно влияет природа противоионов: • чем больше валентность противоиона, тем меньше ДЭС и меньше ζ-потенциал. Если валентность одинакова, то толщина диффузного слоя и ζ-потенциал определяются специфической адсорбцией – увеличение адсорбции вызывает сжатие слоя; • чем больше радиус иона (чем меньше гидратируемость), тем меньше ДЭС; • чем больше поляризуемость, тем меньше ДЭС. Вспомните вечерние прогулки под моросящим дождем в свете фонарей. Какой коллоидно-химический эффект Вы наблюдали в данном случае? С какими свойствами коллоидных систем он связан? Для чего его можно использовать. Дайте обоснованный ответ. ЭФФЕКТ ТИНДАЛЯ (КОНУС ТИНДАЛЯ) Тиндаля эффект - свечение оптически неоднородной среды вследствие рассеяния проходящего через нее света. Обусловлен дифракцией света на отдельных частицах или элементах структурной неоднородности среды, размер которых намного меньше длины волны рассеиваемого света. Характерен для коллоидных систем (например, гидрозолей, табачного дыма) с низкой концентрацией частиц дисперсной фазы, имеющих показатель преломления, отличный от показателя преломления дисперсионной среды. Обычно наблюдается в виде светлого конуса на темном фоне (конус Тиндаля) при пропускании сфокусированного светового пучка сбоку через стеклянную кюПрименение эффекта Основанные на Тиндаля эффекте оптические методы обнаружения, определения размера, формы и концентрации коллоидных частиц и макромолекул (ультрамикроскопия, нефелометрия широко применяются в научных исследованиях и промышленной практике). Пример. Ультрамикроскоп. Ультрамикроскоп - оптический прибор для обнаружения мельчайших (коллоидных) частиц, размеры которых меньше предела разрешения обычных световых микроскопов. Возможность обнаружения таких частиц с помощью ультрамикроскопа обусловлена дифракцией света на них Тиндаля эффектом. При сильном боковом освещении каждая частица в ультрамикроскопе отмечается наблюдателем как яркая точка (светящееся дифракционное пятно) на темном фоне. Вследствие дифракции на мельчайших частицах очень мало света, поэтому в ультрамикроскопе применяют, как правило, сильные источники света. В зависимости от интенсивности освещения, длины световой волны, разности показателей преломления частицы и среды можно обнаружить частицы размерами от 20-50 нм и до 1-5 мк
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 947; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.151.127 (0.018 с.) |

 Ребиндером был сформулирован ряд закономерностей:
Ребиндером был сформулирован ряд закономерностей: γ – эффективная относительная деформация сдвига
γ – эффективная относительная деформация сдвига
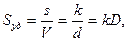
 (8)
(8)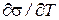 (p = const) всегда отрицателен. В области температур, далеких от критической, и, главным образом, для неассоциированных жидкостей σ изменяется с температурой линейно, и
(p = const) всегда отрицателен. В области температур, далеких от критической, и, главным образом, для неассоциированных жидкостей σ изменяется с температурой линейно, и 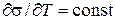 . У. Рамзай и П. Шильс для зависимости поверхностного натяжения от температуры приводят эмпирическое уравнение
. У. Рамзай и П. Шильс для зависимости поверхностного натяжения от температуры приводят эмпирическое уравнение , (1.11)
, (1.11) .
.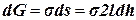 (коэффициент 2 учитывает двусторонность пленки).
(коэффициент 2 учитывает двусторонность пленки). , получаем:
, получаем: 
 .
.

 .
.
 K2SO4≥NaNO3>Ca(NO3)2
K2SO4≥NaNO3>Ca(NO3)2
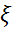
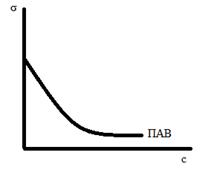 Поверхностно-активные вещества – вещества, которые при адсорбции на границе раздела понижают ее поверхностное натяжение. Такие вещества имеют тенденцию переходить из объема раствора на его поверхность, т. е. происходит их концентрирование на межфазной поверхности. Зависимость поверхностного натяжения раствора от концентрации растворенного вещества при постоянной температуре называется изотермой поверхностного натяжения. ПАВ обладают следующими свойствами: их поверхностное натяжение меньше поверхн. натяжения растворителя; они характеризуются малой растворимостью. При увеличении концентрации ПАВ в растворе его поверхностное натяжение уменьшается по экспоненциальному закону и выходит на плато (прямую) при некоторой концентрации, отвечающей полному заполнению поверхностного слоя молекулами ПАВ. На рисунке изотерма поверхностного натяжения.
Поверхностно-активные вещества – вещества, которые при адсорбции на границе раздела понижают ее поверхностное натяжение. Такие вещества имеют тенденцию переходить из объема раствора на его поверхность, т. е. происходит их концентрирование на межфазной поверхности. Зависимость поверхностного натяжения раствора от концентрации растворенного вещества при постоянной температуре называется изотермой поверхностного натяжения. ПАВ обладают следующими свойствами: их поверхностное натяжение меньше поверхн. натяжения растворителя; они характеризуются малой растворимостью. При увеличении концентрации ПАВ в растворе его поверхностное натяжение уменьшается по экспоненциальному закону и выходит на плато (прямую) при некоторой концентрации, отвечающей полному заполнению поверхностного слоя молекулами ПАВ. На рисунке изотерма поверхностного натяжения.

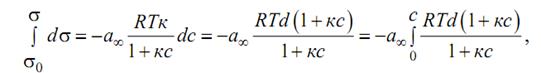
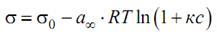 – это уравнение является теоретическим аналогом эмпирического уравнения Шишковского, которое было им получено при исследовании зависимости поверхностного натяжения водных растворов одноосновных карбоновых кислот от их концентрации:
– это уравнение является теоретическим аналогом эмпирического уравнения Шишковского, которое было им получено при исследовании зависимости поверхностного натяжения водных растворов одноосновных карбоновых кислот от их концентрации:
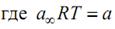 константа, одинаковая для всех членов одного гомологического ряда и мало изменяющаяся для различных рядов с неразветвленными цепями, в – константа адсорбционного равновесия, индивидуальная для каждого ПАВ. Согласно уравнению Шишковского, с ростом с ПАВ σ убывает по логарифмическому закону. При умеренных концентрациях это справедливо. Но для больших концентраций получаем неверный результат: при с→∞ σ стремится к отрицательным значениям, чего, конечно, не может быть. В этом – недостаток данного уравнения. Однако если перейти к поверхностной активности, указанный недостаток становится не столь заметным.С помощью уравнений Гиббса и Ленгмюра можно прояснить физический смысл констант a и b. Константа a связана с величиной максимальной адсорбции a = RT Гmax и не зависит от длины углеводородного радикала молекулы ПАВ только при условии вертикальной ориентации дифильных молекул и их плотной упаковки. Константа b из уравнения Шишковского совпадает с величиной поверхностной активности из уравнения Ленгмюра.
константа, одинаковая для всех членов одного гомологического ряда и мало изменяющаяся для различных рядов с неразветвленными цепями, в – константа адсорбционного равновесия, индивидуальная для каждого ПАВ. Согласно уравнению Шишковского, с ростом с ПАВ σ убывает по логарифмическому закону. При умеренных концентрациях это справедливо. Но для больших концентраций получаем неверный результат: при с→∞ σ стремится к отрицательным значениям, чего, конечно, не может быть. В этом – недостаток данного уравнения. Однако если перейти к поверхностной активности, указанный недостаток становится не столь заметным.С помощью уравнений Гиббса и Ленгмюра можно прояснить физический смысл констант a и b. Константа a связана с величиной максимальной адсорбции a = RT Гmax и не зависит от длины углеводородного радикала молекулы ПАВ только при условии вертикальной ориентации дифильных молекул и их плотной упаковки. Константа b из уравнения Шишковского совпадает с величиной поверхностной активности из уравнения Ленгмюра. структурой ионы. Способность к адсорбции зависит от заряда и размера иона: чем больше размер иона, тем меньше плотность заряда и меньше размеры гидратной оболочки, следовательно, тем легче адсорбируется ион. ДЭС образуется не только на поверхности частиц золей, но и эмульсий.
структурой ионы. Способность к адсорбции зависит от заряда и размера иона: чем больше размер иона, тем меньше плотность заряда и меньше размеры гидратной оболочки, следовательно, тем легче адсорбируется ион. ДЭС образуется не только на поверхности частиц золей, но и эмульсий. Теория Гельмгольца – Перрена. Они представляли ДЭС в виде плоского конденсатора, обкладки которого состоят из слоев противоположных зарядов и расположены на расстоянии порядка молекулярного диаметра. Падение потенциала между слоями ДЭС происходит линейно в зависимости от расстояния от поверхности раздела фаз.
Теория Гельмгольца – Перрена. Они представляли ДЭС в виде плоского конденсатора, обкладки которого состоят из слоев противоположных зарядов и расположены на расстоянии порядка молекулярного диаметра. Падение потенциала между слоями ДЭС происходит линейно в зависимости от расстояния от поверхности раздела фаз.
 –так как по этой теории ζ = φ, то они одинаково зависят от присутствия индифферентных электролитов. Однако было показано, что φ-потенциал не зависит от присутствия индифферентных электролитов, а ζ-потенциал зависит достаточно сильно.
–так как по этой теории ζ = φ, то они одинаково зависят от присутствия индифферентных электролитов. Однако было показано, что φ-потенциал не зависит от присутствия индифферентных электролитов, а ζ-потенциал зависит достаточно сильно. где Wi – работа против сил электростатического притяжения к поверхности. Т. е. имеем облако зарядов с экспоненциально убывающей плотностью. Из графика видно, что чем больше концентрация зарядов, тем круче кривая.
где Wi – работа против сил электростатического притяжения к поверхности. Т. е. имеем облако зарядов с экспоненциально убывающей плотностью. Из графика видно, что чем больше концентрация зарядов, тем круче кривая.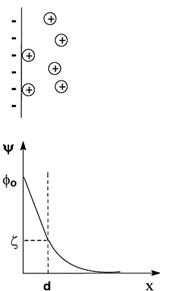 Недостатки теории:
Недостатки теории:


