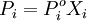Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация дисперсных систем по агрегатным состояниям фаз.Содержание книги
Поиск на нашем сайте
Образование дисперсных систем. Возможно двумя путями: диспергационным и конденсационным. Диспергирование макрофаз с образованием лиофильных дисперсных систем происходит самопроизвольно - для этого достаточно энергии теплового движения. Такой процесс осуществляется при значениях поверхностного натяжения ниже нек-рого критич. значения кр = kТ/2, где - размер частицдисперсной фазы, Т - абс. т-ра, k - постоянная Больцмана, - безразмерный коэф., принимающий значения примерно 10-30.Образование лиофобных дисперсных систем путем диспергирования стабильной макрофазы требует значительных энергетич. затрат, определяемых суммарной площадью пов-сти частиц дисперсной фазы. В реальных условиях на образование пов-сти при измельчениитвердых тел или при распылении и эмульгировании жидкостей приходится лишь небольшая часть (доли процента) подводимой к системе энергии; остальное расходуется на побочные процессы и рассеивается в окружающем пространстве (см. Диспергирование).Конденсационный путь образования дисперсных систем связан с зарождением новой фазы (или новых фаз) в пересыщенной метастабильной исходной фазе - будущей дисперсионной среде. Для возникновения высокодисперсной системы необходимо, чтобы число зародышей новой фазы было достаточно большим, а скорость их роста не слишком велика. Кроме того, требуется наличие факторов, ограничивающих возможности чрезмерного разрастания и сцепления частиц дисперсной фазы. Переход первоначально стабильной гомог. системы в метастабилъное состояние может произойти в результате изменения термодинамич. параметров состояния (давления, т-ры, состава). Так образуются, напр., природные и искусственные аэрозоли (туман - из переохлажденных водяных паров, дымы - из парогазовых смесей, выделяемых при неполном сгорании топлива), нек-рые полимерные системы - из р-ров при ухудшении "термодинамич. качества" р-рителя, органозоли металлов путем конденсации паров металла совместно с парами орг.жидкости или при пропускании первых через слой орг. жидкости, коллоидно-дисперсные поликристаллич. тела (металлич. сплавы, нек-рые виды горных пород и искусств. неорг. материалов). Возможно также образование дисперсных систем в результате хим. р-ции в гомог. среде, если продукт р-ции при данных условиях находится в агрегатном состоянии, отличном от "материнской" фазы, или практически не растворяется в ней. Примерами подобных систем могут служить аэрозоли с твердыми частицами NH4Cl (образуются при взаимод. газообразных NH3 и НСl), аэрозоли с капелъно-жидкими частицами H2SO4 (при взаимод. SO3 и водяного пара). В природе и технол. процессах часто образуются гидрозоли разного состава при гидролизе солей и др. соед., неустойчивых к действию воды. Окислит.-восстановит. р-ции используют для получения золей Аu и Ag, разложение Na2S2O3 разб. серной или соляной к-той - для получения гидрозоля элементарной серы. Хим. или термохим. разложения карбонатов, орг. порофоров (порообразователей,вспенивающих агентов) и др. соед. с выделением газообразных в-в в первоначально жидких средах лежит в основе пром. произ-ва мн. пеноматериалов. 35. Грубодисперсные системы, к которым относятся суспензии, эмульсии, пены и аэрозоли, различающиеся по фазовому составудисперсной фазы и дисперсионной среды, рассматриваются в одном разделе курса коллоидной химии благодаря общности таких свойств, которые определяются размером частиц дисперсной фазы. Вместе с тем каждая из этих систем обладает и присущими только ей свойствами. В этой связи в данной главе свойства каждого типа систем рассматриваются самостоятельно. Суспензии – это грубодисперсные системы, в которых дисперсная фаза – твердое тело, а дисперсионная среда - жидкость. Размер частиц в суспензиях – 10-6-10-5 м. Суспензии имеют большое практическое значение, даже значительно большее, чем золи. Только лакокрасочная, полиграфическая и текстильная промышленность потребляют огромное количество суспензий пигментов и красящих веществ, диспергированных в водеили углеводородах. Угольные и графитовые суспензии широко применяются для предотвращения образования накипи в котлах. Здесь частички используются как центры кристаллизации солей. Бурение скважин сопровождается закачкой в них глинистых суспензий. Концентрированные суспензии (пасты) - основа технологического использования цементов, керамики, кирпичного производства и производства других строительных материалов. Сельское хозяйство также связано с использованием суспензий, так как почвы с водойдают типичные суспензии. Препараты для обработки семян и растений в борьбе с вредителями также часто применяются в виде суспензий. 36. Коллоидные системы, коллоидно-дисперсные системы, коллоиды, традиционные названия предельно высокодисперсных (микрогетерогенных) систем. Частицы дисперсной фазы в коллоидных системах, коллоидные частицы, обычно имеют размер от 10-7 до 10-5 см. В газе или жидкости они свободно и независимо одна от другой участвуют в интенсивном броуновском движении, равномерно заполняя весь объем дисперсионной среды. Такие свободнодисперсные коллоидные системы (дымы, золи) седиментационно устойчивы, то есть их частицы не выпадают в осадок. В процессе броуновского движения и при перемешивании коллоидные частицы сталкиваются. Если при этом не происходит укрупнения частиц вследствие их слипания (коагуляции) или слияния (коалесценции), токоллоидные системы являются агрегативно устойчивыми (например, лиофильные и стабилизованные лиофобные коллоидные системы, см. Лиофильные и лиофобные коллоиды). Коллоидные системы образуются при конденсации вещества в гомогенной среде (пересыщенном растворе, паре, переохлажденнойжидкости), если возникающие в ней зародыши новой дисперсной фазы, то есть мельчайшие капли или кристаллики, не получают возможности расти до размеров, превышающих 10-5 — 10-4 см. Конденсация часто сопровождает химические реакции, в результате которых образуются трудно-растворимые соединения. Другой путь получения коллоидных систем — диспергирование, самопроизвольное в случае лиофильных и принудительное в случае лиофобных систем. Существование жидких агрегативно устойчивых лиофобных коллоидных систем всегда обусловлено наличием в дисперсионной среде поверхностно-активных веществ —стабилизаторов. Эти вещества создают на поверхности частиц адсорбционно-сольватный защитный слой, препятствующий их сближению и коагуляции под влиянием близкодействующих сил молекулярного притяжения. Препятствием к сближению частиц могут быть расклинивающее давление жидкой дисперсионной среды, сольватно связанной (см. Сольватация) в адсорбционном слоемолекулами или ионами стабилизатора; электростатическое отталкивание одноименно заряженных ионов, адсорбированных на поверхности частиц; повышенная структурная вязкость поверхностного защитного слоя, так называемый структурно-механический барьер. Неструктурированные жидкие коллоидные системы, золи, по комплексу свойств занимают промежуточное положение междугрубодисперсными системами и растворами. При ослаблении в лиофобных золях защитного действия стабилизаторов (астабилизация, или дестабилизация, системы) возникают структурированные коллоидные системы — гели (см. также Дисперсная структура). Кколлоидным системам относят и твёрдые микрогетерогенные системы — мелкозернистые тела (некоторые минералы, сплавы, закристаллизованные стекла и др.), в которых величина структурных элементов или включений не выходит за пределы коллоидных размеров. Характерной чертой дисперсных систем является их исключительное многообразие, которое можно объяснить изменениями: · степени раздробленности дисперсной фазы; · агрегатного состояния дисперсионной среды и дисперсной фазы; · химического состава фаз. 37. Раздел «Устойчивость и коагуляция дисперсных систем» считается одним из центральных в курсе коллоидной химии. Связано это с тем, что устойчивость дисперсий и нарушение ее (коагуляция) играют большое значение во многих технологических процессах, связанных с их применением. Например, при синтезе латексов синтетических полимеров дисперсная система должна быть устойчивой во избежание потерь полимера в результате образования коагулюма. Целевое выделение полимера из латекса возможно, наоборот, только при нарушении устойчивости, т.е. при управляемой коагуляции. Использование латексов синтетических полимеров для модификации тканей с целью придания им новых свойств (формоустойчивости, масло-, кислото-, водоотталкивания), связано с процессом гетерокоагуляции частиц полимеров на поверхности волокон в тканях. Устойчивость дисперсных систем (пигментов в поликонденсационных и полимеризационных системах) позволяет получать пигментированные волокна. Нарушение устойчивости дисперсий пигментов в растворах или расплавах полимеров и образование агрегатов частиц способны вызвать разрыв при формовании волокон в результате разрыва целостности текущего пигментированного раствора или расплава. Стабильность печатных пигментированных красок, используемых для колорирования тканей, также влияет на процесс печати, на оттенок и даже на цвет пигментов в полимерных пленках на поверхности тканей. Очевидно, что знание закономерностей создания устойчивых систем и их коагуляции имеет не только теоретический, но и практический интерес для специалистов, занимающихся проблемами получения химических волокон, производства текстильных материалов и применения латексов. В этой связи данный раздел будет полезным для студентов – будущих инженеров, химиков-технологов, специалистов по производству химических волокон, текстильных и нетканых материалов. Особенно важно знание этих проблем для будущих специалистов в области инженерной охраны окружающей среды методами очистки сточных вод и газовых выбросов от вредныхвеществ, так как широкий ряд способов очистки основан именно на коагуляции дисперсных загрязнений. 38. Общая характеристика растворов. Растворами называются гомогенные системы переменного состава, в которых растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя.
Согласно второму началу термодинамики при р, Т = = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е. ?G = (?Н – T?S) < 0. Величину?Н называют энтальпийным фактором, а величину T?S – энтропийным фактором растворения. При растворении жидких и твердых веществ энтропия системы обычно возрастает (?S > 0), так как растворяе–мые вещества из более упорядоченного состояния пе–реходят в менее упорядоченное. Вклад энтропийного фактора, способствующий увеличению растворимости, особенно заметен при повышенных температурах, по–тому что в этом случае множитель Т велик и абсолютное значение произведения T?S также велико, соответст–венно возрастает убыль энергии Гиббса. При растворении газов в жидкости энтропия системы обычно уменьшается (?S < 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множи–тель Т мал и абсолютное значение произведения T?S будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т. В процессе образования раствора энтальпия систе–мы также может как увеличиваться (NaCI), так и умень–шаться (КОН). Изменение энтальпии процесса раство–рения нужно рассматривать в соответствии с законом Гесса как алгебраическую сумму эндо– и экзотермиче–ских вкладов всех процессов, сопровождающих про–цесс растворения. Это эндотермические эффекты раз–рушения кристаллической решетки веществ, разрыва связи молекул, разрушения исходной структуры рас–творителя и экзотермические эффекты образова–ния различных продуктов взаимодействия, в том числе сольватов. Для простоты изложения приращение энтальпии раст–ворения?Нраств можно представить как разность энер–гии Екр, затрачиваемой на разрушение кристаллической решетки растворяемого вещества, и энергии Есол, выде–ляющейся при сольватации частиц растворенного веще–ства молекулами растворителя. Иначе говоря, измене–ние энтальпии представляет собой алгебраическую сумму изменения энтальпии?Нкр в результате разруше–ния кристаллической решетки и изменения энтальпии?Нсол за счет сольватации частицами растворителя: ?Нраств =?Нкр +?Нсол, где?Нраств – изменение энтальпии при растворении. Однако растворение благородных газов в органичес–ких растворителях нередко сопровождается поглоще–нием теплоты, например гелия и неона в ацетоне, бен–золе, этаноле, циклогексане. При растворении твердых веществ с молекулярной кристаллической структурой и жидкостей молекуляр–ные связи не очень прочные, и поэтому обычно?Нсол >?Нкр Это приводит к тому, что растворение, например, спиртов и сахаров представляет собой экзотермиче–ский процесс (?Нраств < 0). При растворении твердых веществ с ионной решет–кой соотношение энергий Екр и Есолмогут быть различ–ным. Однако в большинстве случаев энергия, выделяе–мая при сольватации ионов, не компенсирует энергию, затрачиваемую на разрушение кристаллической решет–ки, следовательно, и процесс растворения является эн–дотермическим. Таким образом, термодинамические данные позво–ляют прогнозировать самопроизвольное растворение различных веществ на основе первого и второго начал термодинамики.
Процесс растворения газов в металлах можно разделить на несколько элементарных кинетических стадий: 1) поступление частиц из газовой фазы к поверхности металла; 2) адсорбция газа на этой поверхности, сопровождающаяся диссоциацией, а в соответствующих условиях и образованием химического соединения газа с одним из компонентов металла; 3) переход адсорбированных атомов с поверхности в раствор; 4) перенос растворенных атомов с поверхности металла в его объем в результате выравнивания концентрации газа в металле, осуществляемого атомарной диффузией частиц газа в твердых металлах и конвективной диффузией в расплавах. Эти же кинетические стадии, но в обратном порядке характеризуют кинетику процесса десорбции. В обоих случаях скорость суммарного процесса будет лимитироваться и определяться скоростями наиболее медленных стадий процесса. Из-за отсутствия каких-либо экспериментальных данных в настоящее время не представляется возможным выделить в самостоятельные кинетические стадии процессы: переход адсорбированных газов с поверхности металла в растворенное состояние при сорбции газа металлом и обратный их переход при десорбции. Скорость перемещения частиц газа к поверхности металла и от нее, рассчитываемая по известным уравне- ниям молекулярно-кинетической теории газа, велика и обычно не определяет кинетику растворения. Поэтому анализ кинетики сорбционных и десорбционных процессов по существу сводится к разделению скорости пронес» сов, протекающих на поверхности раздела, — адсорбции или десорбции, и скорости массопереноса газа с поверхности или к ней в объеме металла. Уравнение Ленгмюра для кинетики мономолекулярной адсорбции выведено исходя из предположения, что энергия связи газа с поверхностью не зависит от ее заполнения. Как отмечалось выше, это предположение не оправдывается для твердой поверхности, по, по-видимому, справедливо для жидкого металла. В последнем случае характер лимитирующей стадии можно определить по виду зависимости начальной скорости процесса от давления растворяющегося газа; скорость адсорбции по уравнению (1-6) пропорциональна давлению в первой степени, а скорости последующих стадий процесса растворения — корню квадратному из его парциального давления. Как было показано в первой главе, для твердой энергетически неоднородной поверхности этот критерий не является достаточно надежным, так как адсорбция может в свою очередь лимитироваться активированной миграцией адсорбированных атомов газа на поверхности, также пропорциональной корню квадратному из давления. Массоперенос или диффузия атомов газа в твердых металлах протекает иначе, чем в жидких. В твердом металле атомы растворенного газа перемещаются из одних междоузлий кристаллической решетки в другие вследствие их перераспределения в объеме металла; в жидких расплавах выравнивание концентрации растворенного газа достигается главным образом перемещением отдельных объемов абсорбента. Поэтому кинетикурастворения (и десорбции) газов твердыми и жидкими металлами следует рассматривать раздельно. ГИДРАТЫ, продукты присоединения воды (гидратации)к молекулам, атомам или ионам. М. б. газообразными, жидкими и твердыми; последние наз. кристаллогидратами. В р-ре многозарядные ионы (А13+, Сг3+, Be2+ и др.) и небольшие однозарядные (Li+) достаточно прочно связывают ближайшие к ниммолекулы воды, образуя аквакатионы, напр. [А1(Н2О)6]3+. Кристаллогидраты солей обычно образуются в тех случаях, когда катионы в их кристаллич. решетке образуют более прочные связи с молекулами Н2О, чем с анионами в решетке безводной соли. При низких т-рахвода в кристаллогидратах м. б. связана и с катионом, и с анионом соли. Напр., у MgCl2*12Н2О ниже — 25 °С в кристаллич. решетке находятся акваионы [Mg(H2O)6]2+ и [С1(Н2О)6]-. Воду, входящую в состав кристаллогидратов, наз. кристаллизационной. Существуют также псевдогидраты-соед., в к-рых все или часть молекул воды превращаются в гидроксид-ионы или ионы гидроксония, напр. Sr(BO2)2*4H2O (по существу это Sr[B(OH)4]2) и НС1О4*Н,О [или (Н3О)С1О4]. Воду, входящую в состав псевдогидратов, наз. конституционной. В каждом кристаллогидрате молекулы воды располагаются определенным образом. Так, в [А1(Н2О)6]С13 вода входит в состав аквакатиона, в гидратах цеолитов размещается в пустотах сетчатой ионной структуры. В соед. типа Mg2(OH)2(H2O)3CO3цепочки молекул воды находятся в каналах структуры. Вода может связывать аквакатион с анионом водородными связями, напр. CuSO4*5H2O или [Cu(H2O)4](H2O)SO4. Существуют кристаллогидраты, в к-рых вода образует слои, объединяемые ионами соли(CaSO4*2H2O и др.). Известны тектогидраты, в к-рых молекулы воды образуют непрерывную фазу со структурой, подобной структурельда, включающую др. молекулы или ионы (Na2S04*10H2O, H3[PW12O40]*29H2O и др.). Если посторонняя молекула в структуру льда не встраивается, то образуется эвтектич. тонкая мех. смесь льда и соли, иногда наз. криогидратом. При удалении воды мн.кристаллогидраты солей превращаются в низшие кристаллогидраты или в безводные соли с иной (по сравнению с исходной) кристаллич. структурой, но часто в результате гидролиза при обезвоживании образуются гидроксосоли, гидроксиды или оксиды. Кристаллич. структура кристаллогидратов солей, содержащих воду в пустотах или каналах структуры, при обезвоживании часто не изменяется. Каждый кристаллогидрат устойчив лишь в определенном температурном интервале, поэтому кривые их р-римости имеют изломы, соответствующие превращениям одного кристаллогидрата в другой. Для каждого кристаллогидрата характерно определенное равновесное давление водяного пара, зависящее от т-ры. Если это давление над кристаллогидратом больше, чем парциальноедавление водяных паров в окружающей среде при той же температуре, то кристаллогидрат постепенно теряет воду ("выветривается"); в противоположном случае кристаллогидрат поглощает воду и даже может в ней раствориться ("расплывается") Существуют кристаллогидраты [Fe(NO3)2*9Н2О, СаС12*6Н2О и др.], к-рые самопроизвольно не кристаллизуются ни при каком пересыщении. С увеличением числа молекул кристаллизац. воды энтальпия растворения кристаллогидратов уменьшается по абс. величине и становится даже положит. величиной. О гидратах газов см. Газовые гидраты. 39. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав к-рых может изменяться непрерывным образом (по крайней мере, в нек-рых пределах). В отличие от растворов электролитов, в растворах неэлектролитов (мол. р-рах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. В данной статье рассматриваются жидкие р-ры; см. также Твердые растворы. Взаимная р-римость двух жидкостей при заданных т-ре Т и давлении р м. б. полной (неограниченной) или ограниченной. В последнем случае р-ры в нек-рой области составов расслаиваются, т. е. разделяются на две жидкие фазы, отличающиеся по концентрации. В многокомпонентных расслаивающихся р-рах число сосуществующих жидких фаз м. б. более двух. Если один (или более) из компонентовраствора неэлектролитов в чистом состоянии при заданных Т и р является газом или твердым телом, область существования растворанеэлектролитов простирается от чистой жидкости (смеси жидкостей), выступающей в роли р-рителя, до состава, отвечающего насыщ. р-ру. Растворы неэлектролитов служат средой, в к-рой протекают многие прир. и пром. процессы. Изучение и прогнозирование св-в этих систем тесно связаны с такими практич. проблемами, как подбор р-рителей для реализации технол. процессов, получение систем с заданными св-вами, разделение прир. и пром. смесей (включая газы и нефти), глубокая очистка в-в. Физ. химия изучает широкий диапазон св-в р-ров. Наиб. разработана и имеет практически важные применения равновеснаятермодинамика р-ров; дальнейший материал посвящен в осн. этому разделу физ. химии р-ров. Кроме того, изучаются транспортные св-ва р-ров-диффузия, теплопроводность, вязкость (см. Физико-химическая гидродинамика), а также спектроскопич., электрич., акустич. и др. физ. св-ва. Методы исследования макроскопич. св-в растворов неэлектролитов и их структурных характеристик во многом аналогичны методам исследования индивидуальных жидкостей, но осн. внимание уделяется рассмотрению концентрац. зависимостей св-в. Важнейшая задача физ.-хим. исследований - установление связи между наблюдаемыми на опыте св-вами, структурой р-ров и характеристиками межмолекулярных взаимодействий. Эксперим. информацию о структуре р-ров и межмолекулярных взаимод. в них дают методы оптической и радиоспектроскопии, дифракционные, электрич. и др. Важную роль в изучении растворов неэлектролитов играет физико-химический анализ, основанный на построении и исследовании фазовых диаграмм, концентрац. зависимостей термодинамич. и др. физ. св-в (показателя преломления, вязкости, теплопроводности, акустич. характеристик и др.). При этом одна из главных задач состоит в том, чтобы на основании анализа диаграмм состав - свойство устанавливать факт образования хим. соединений между компонентами растворов неэлектролитов и находить их характеристики. Осмос (от греч. ōsmós — толчок, давление), диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации. Полупроницаемая мембрана — перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Выравниваниеконцентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному. Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить осмос, т. е. создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращениюосмоса — обратной диффузии растворителя (см. Ультрафильтрация). В случаях, когда мембрана проницаема не только длярастворителя, но и для некоторых растворённых веществ, диффузия последних из раствора в растворитель позволяет осуществитьдиализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов. Впервые осмос наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие. Осмос имеет важнейшее значение в биологических процессах (см. Осморегуляция), его широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом «обратного» осмоса жидкостей. смос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки. Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию. Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
ДИФФУЗИЯ (от лат. diflusio - распространение, растекание, рассеивание), перенос частиц разной природы, обусловленный хаотич. тепловым движением молекул (атомов) в одно-или многокомпонентных газовых либо конденсир. средах. Такой перенос осуществляется при наличии градиента концентрации частиц или при его отсутствии; в последнем случае процесс наз. самодиффузией (см. ниже). Различают диффузию коллоидных частиц (т. наз. броуновская диффузия), в твердых телах, молекулярную, нейтронов, носителей заряда в полупроводниках и др.; о переносе частиц в движущейся с определенной скоростью среде (конвективная диффузия) см. Массообмен.Переноса процессы, о диффузии частиц в турбулентных потоках см. Турбулентная диффузия. Все указанные виды диффузии описываются одними и теми же феноменологич. соотношениями. Применение диффузии. Диффузия используется при выплавке стали. Для придания стальным деталям прочности их помещают в специальные печи, где, находясь в разогретом состоянии, они насыщаются кислородом. Атомы углерода проникают в поверхностный слой металла и повышают его прочность. С ее помощью изготавливают многие полупроводниковые приборы. 40. Первый закон Рауля Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом: · Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку: · Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силымежмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Отклонения от закона Рауля Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных — отрицательные отклонения. Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений). Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0). Второй закон Рауля Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля. Вант-Гоффа закон осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества. Открыт Я. Х. Вант-Гоффом. Антифриз (от греч. ἀντι- — против и англ. freeze — замерзать) — общее название для жидкостей, не замерзающих при низких температурах. Применяются в установках, работающих при низких температурах, для охлаждения двигателей внутреннего сгорания, в качестве авиационных противообледенительных жидкостей. В качестве базовых жидкостей антифризов используются смеси этиленгликоля, пропиленгликоля, глицерина, одноатомных спиртов и других веществ с водой. 41. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав к-рых может изменяться непрерывным образом (по крайней мере, в нек-рых пределах). В отличие от растворов электролитов, в растворах неэлектролитов (мол. р-рах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. В данной статье рассматриваются жидкие р-ры; см. также Твердые растворы. Взаимная р-римость двух жидкостей при заданных т-ре Т и давлении р м. б. полной (неограниченной) или ограниченной. В последнем случае р-ры в нек-рой области составов расслаиваются, т. е. разделяются на две жидкие фазы, отличающиеся по концентрации. В многокомпонентных расслаивающихся р-рах число сосуществующих жидких фаз м. б. более двух. Если один (или более) из компонентовраствора неэлектролитов в чистом состоянии при заданных Т и р является газом или твердым телом, область существования растворанеэлектролитов простирается от чистой жидкости (смеси жидкостей), выступающей в роли р-рителя, до состава, отвечающего насыщ. р-ру. Растворы неэлектролитов служат средой, в к-рой протекают многие прир. и пром. п
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 361; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.54.118 (0.013 с.) |