
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства веществ в различных физических состоянияхСодержание книги
Поиск на нашем сайте
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
Билет. Жи́дкие криста́ллы - это фазовое состояние, в которое переходят некоторые вещества при определенных условиях (температура, давление, концентрация в растворе). Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всем объёме этой жидкости. Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности. По типу ЖК обычно разделяют на две большие группы: нематики и смектики. В свою очередь нематики подразделяются на собственно нематические и холестерические жидкие кристаллы. ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма), графич. изображение всех возможных состояний термодинамическое системы в пространстве основные параметров состояния температуры Т, давления р и состава х (обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем, состоящих из многих фаз и компонентов, построение ДИАГРАММА СОСТОЯНИЯ с. является единственным методом, позволяющим на практике установить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния. Твёрдые растворы - фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решётке. На диаграмме различают три фазовые области:
1. Выше линии ликвидуса АDВ находится область жидкой фазы Ж.
2. Под ней до линии солидуса АDВ расположена двухфазная область б + Ж. Фаза б представляет твердый раствор компонентов А и В, зерна имеют единую кристаллическую решетку. Однако у сплавов разного состава число атомов компонентов А и В в элементарных ячейках решетки различно.
3. Область, расположенная под линией солидуса, является однофазной (фаза б).
Типы диаграмм состояния. На диаграмме состояния двойных систем в координатах температура-состав образованию непрерывных твердых растворов отвечают три типа линий ликвидуса и солидуса. Билет 26 Термодинамическая система - это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям.
Термодинамические системы подразделяются на однородные по составу (например, газ в сосуде) и неоднородные (вода и пар или смесь газов в сосуде).
Выделяют также изолированные системы, то есть системы, которые не обмениваются с окружающей средой ни энергией, ни веществом, и закрытые системы, которые обмениваются со средой только энергией, но не обмениваются веществом. Если же в системе происходят обменные процессы с окружающей средой, то её называют открытой.
Закон:" число фаз, сосуществующих в равновесии, не превосходит числа независимых компонентов более чем на 2." Правило фаз Гиббса определяет соотношение между числом фаз (Ф), компонентов (К), внешних переменных (П) и числом степеней свободы или вариантности (С) термодинамической системы, находящейся в равновесии и записывается следующим образом:
С = К + 2 - Ф;
Цифра 2 в правиле фаз связана с существованием 2-х переменных (температуры и давления), одинаковых для всех фаз. Например, правило фаз Гиббса для постоянного давления запишется как:
С = К +1 – Ф Билет 27 Слово "термодинамика" происходит от греческих слов "термос" - тепло и "динамос" - сила, мощь.
Термодинамика изучает законы превращения энергии из одной формы в другую в различных процессах. Выделяют общую или физическую термодинамику (изучает общие вопросы превращения энергии); техническую термодинамику (изучает взаимопревращение между теплотой и механической работой) и химическую термодинамику (изучает превращение различных форм энергии в ходе химической реакции и при фазовых переходах, а также способность химических систем выполнять полезную работу).
Химическая термодинамика используется для решения таких задач, как 1) предсказание о возможности протекания химической реакции; 2) о направленности химической реакции; 3) о характере химического процесса.
Основным объектом исследования термодинамики является система. Это понятие означает ту часть материального мира, которая является предметом наблюдения или исследования. Это тело или группа тел, выделенных мысленно из материального мира (газ в баллоне, образец вещества, тепловая машина и т.д.). Остальная часть материального мира - за пределами условно выделенной из него системы - называется окружением или окружающей средой. Между средой и системой возможен обмен веществом и энергией.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. ΔU = Q - A. Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме: Q = ΔU + A. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами. Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T2) - U (T1). Здесь U (T1) и U (T2) - внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p (V2 - V1) = p ΔV. Первый закон термодинамики для изобарного процесса дает: Q = U (T2) - U (T1) + p (V2 - V1) = ΔU + p ΔV. При изобарном расширении Q > 0 - тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 - тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0. Билет 28 Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
где Мерой изменения упорядоченности системы служит изменение энтропии ΔS. Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца: ΔG = ΔH - T · ΔS Стандартные энтальпия и энтропия даются в таблицах.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.77.119 (0.008 с.) |





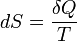 ,
, — приращение энтропии;
— приращение энтропии; 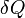 — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
— минимальная теплота, подведенная к системе; T — абсолютная температура процесса;


