
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхностная активность. Экспериментальное определение, изменение в гомологических рядах, работа адсорбции.Содержание книги
Поиск на нашем сайте
Величина Поверхностная активность – это мера способности вещества изменять поверхностное натяжение. Очевидно, что чем больше величина g, тем сильнее способность вещества понижать поверхностное натяжение.
Поверхностная активность равняется тангенсу угла a (т. е. отношению приращения σ к приращению с): g = tg a Для характеристики процессов адсорбции с ориентацией адсорбирующихся молекул (например, с ориентацией дифильных молекул ПАВ на поверхности раствора) вводится понятие работы адсорбции. Работа адсорбции в этом случае – это работа, которую совершает система при обратимом изотермическом переносе полярной и неполярной частей молекулы из объема фазы на межфазную поверхность:
По Ленгмюру: В гомологическом ряду нормальных алифатических кислот поверхностная активность по отношению к воде резко возрастает, в среднем, в 3-3,5 раза на каждую группу –СН2. Как влияет температура на термодинамические функции поверхностного слоя в однокомпонентных жидкостях на границе с собственным паром? Как экспериментально можно определить полную поверхностную энергию жидкости? При постоянной температуре и давлении поверхностная энергия Гиббса определяется произведением поверхностного натяжения (фактор интенсивности) s на площадь поверхности (фактор емкости ) s: GS=σs
где – V – объем дисперсной фазы, мл; k – коэффициент формы частиц; d -диаметр частицы, м2.
Поверхностное натяжение можно представить как энергию переноса молекул из объема тела на поверхность или как работу образования единицы поверхности. Поверхностное натяжение можно выразить частной производной от энергии Гиббса по величине межфазной поверхности при p и T=const (при постоянных числах молей компонентов):
Поверхностное натяжение жидкости, как и другие ее свойства, связанные с тепловым движением молекул, зависит от температуры. В самом деле, с повышением температуры увеличивается интенсивность теплового движения молекул, вследствие чего межмолекулярные силы ослабевают, и поверхностное натяжение падает. Поэтому температурный коэффициент чистой жидкости
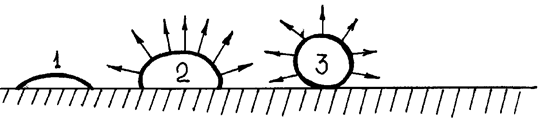
где К и а – постоянные величины, зависящие от природы жидкости; Т кр – критическая температура; Т – температура опыта. Экспериментальные данные свидетельствуют, что при приближении температуры к Т кр наблюдаются отклонения от линейной зависимости s от Т. Рассмотрим опыт Дюпре: На проволочной рамке образуем мыльную пленку. Нижняя сторона рамки – подвижная и, если ничем не нагружена, поднимается вверх из-за стремления пленки сократиться, т. е. На рамку действует сила поверхностного натяжения Fп. Эту силу можно уравновесить грузиком весом Р = Fп. При увеличении веса груза на бесконечно малую величину происходит перемещение подвижной стороны рамки на dh Груз при этом совершает работу против силы Fп: Одновременно из-за увеличения поверхности пленки возрастает поверхностная энергия: Так как Таким образом, величина σ может рассматриваться не только как удельная поверхностная энергия, но и как сила, отнесенная к единице длины контура, ограничивающего поверхность. 4. Почему бумага впитывает воду, а плащевая ткань не промокает? Какое коллоидно-химическое явление лежит в основе этих процессов? Охарактеризуйте его. Плащевая ткань может иметь следующий состав: полиэфир 100%, полиэфир + хлопок, полиамид + хлопок, полиэфир + вискоза. Содержание хлопка или вискозы приближает ее по гигиеническим показателям к натуральным тканям, сохраняя при этом лучшие свойства синтетики. Изделия из смесовых тканей могут иметь масловодоотталкивающую пропитку, которая придает ткани высокие масло- и грязеотталкивающие свойства. Щелочная отварка является основной операцией процесса подготовки хлопчатобумажных тканей. Назначение этого процесса заключается в удалении природных примесей целлюлозы, а также примесей, нанесенных на волокно в прядении и ткачестве. Одновременно с этим необходимо обеспечить равномерную и высокую смачивающую и сорбционную способность при максимальном сохранении исходных физико-механических свойств хлопкового волокна. Это достигается в результате происходящих при отварке сложных физических, химических и коллоидно-химических процессов, таких как адсорбция, диффузия, набухание, растворение, эмульгирование, гидролиз и окисление. Эффективное удаление примесей целлюлозы и получение высокой капиллярности достигается лишь при горячих щелочных обработках. Гидрофобные свойства хлопка обусловлены наличием на наружной поверхности волокна пектиновых, азотсодержащих (белковых) и воскообразных примесей. В процессе отварки в волокне протекают следующие химические процессы. Пектиновые вещества под действием щелочи при высокой температуре гидролизуются с образованием водорастворимых продуктов (пентозы, гексозы и др.) Белковые соединения в щелочной среде гидролизуются, а образующиеся натриевые соли аминокислот не только способны переходить в раствор, но и являются хорошими эмульгаторами, способствующими интенсивному удалению воскообразных веществ и других загрязнений с поверхности волокна. Воскообразные примеси, представляющие собой сложные эфиры высших кислот с жирными спиртами, частично гидролизуются под действием щелочи:
Выделяющиеся при этом, хотя и в незначительном количестве, жирные кислоты (пальмитиновая, стеариновая, олеиновая) под влиянием щелочи образуют натриевые соли – мыла, обладающие высокой поверхностной активностью, хорошей растворимостью в воде и высокой эмульгирующей способностью. Такие вещества называют поверхностно-активными (ПАВ), поскольку они способны снижать поверхностное натяжение на поверхности раздела фаз «варочная жидкость – воскообразные частицы». Молекулы ПАВ своими гидрофобными концами вступают в контакт с воскообразными примесями и полярными гидрофильными группами ориентируются в сторону варочного раствора. При этом расплавленная капля воска стягивается по периметру, превращаясь в шарообразную микрокаплю, удерживаемую поверхностью волокна в одной точке как это показано на рис.1.
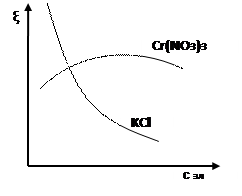
волокно Рис.1. Механизм эмульгирования воскообразных примесей Эмульгированные поверхностно-активными веществами воскообразные частицы отрываются от поверхности волокна и переходят в раствор, образуя устойчивую эмульсионную систему. Путем омыления жировых веществ удаляется около 40% воскообразных примесей, остальные выводят из волокна введением в варочную жидкость дополнительного количества ПАВ. Последние должны обладать не только поверхностно-активными свойствами, но и высокой эмульгирующей способностью, то есть не вызывать слипания частиц и расслаивания эмульсии. ПАВ должны биологически расщепляться в сточных водах, обладать устойчивостью к действию высоких температур и быть сравнительно недорогими. Экстрагированные из волокна примеси и образующиеся при отварке осадки гидроксидов металлов должны удерживаться в растворе и повторно не сорбироваться волокном. Минеральные вещества, сопутствующие целлюлозе, при взаимодействии со щёлочью образуют гидраты, растворимые в воде, и удаляются при промывке. В процессе отварки не исключена возможность каталитического окисления целлюлозы активным кислородом, так как при высокой температуре обработки кислород воздуха в присутствии щелочей образует перекисные соединения. Последние взаимодействуют с целлюлозой, в результате чего получается оксицеллюлоза. Об этом свидетельствует снижение вязкости медно-аммиачных растворов целлюлозы в процессе варки. Данные теоретические предпосылки учитываются при реализации процесса отварки на практике. Так в состав варочной жидкости кроме гидроксида натрия (основного компонента, разрушающего практически все примеси) и ПАВ дополнительно вводят силикат натрия – Na2SiO3 и восстановители (традиционно бисульфит натрия – NaHSO3). Силикат натрия адсорбирует продукты распада естественных примесей целлюлозы и тем самым устраняет возможность их повторного осаждения на волокно. Кроме того, он выступает в качестве защитного средства, препятствующего образованию на ткани осадков гидроксидов металлов в виде ржавых пятен. Последние образуются в варочной жидкости из компонентов, содержащихся в воде – солей железа, солей жёсткости и др. – в виде устойчивых коллоидных гидрозолей. Силикат натрия коагулирует их, превращая в грубодисперсные частицы, не способные сорбироваться волокном. Восстановители в составе варочной жидкости выполняют две функции: защищают целлюлозу от окисляющего действия кислорода воздуха и способствуют удалению лигнина, содержащегося в механических примесях в виде «галочек». Помимо бисульфита натрия, в условиях непрерывных процессов отварки при высоких концентрациях щёлочи, в качестве восстановителей рекомендуют использовать ронгалит, диоксид тиомочевины, тиомочевину, сульфид натрия, а в последние годы – антрахинон и его производные. 5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А - Na2 SiO3, В - HCl, С - H2SiO3 При избытке HCl: { m (H2SiO3) nH+ (n -x)Cl- }х+ хCl- При избытке Na2SiO3: { m (H2SiO3) nSiO32- 2(n -x)Na+ }2х- 2х Na+ 6. Определите тип электролитов: KNO3, NaOH, Cr(NO3)3 по отношению к золю Cr(OН)3 (стабилизатор CrCl3). Проиллюстрируйте графически, как влияет на величину ζ-потенциала добавление к золю растворов Cr(NO3)3, KCl. KNO3- индеферентный, NaOH- неиндеферентный, Cr(NO3)3 – неиндеферентный
Cr(NO3)3 Если один из ионов электролита способен достраивать кристаллическую решетку коллоидной частицы, то он повышает ζ-потенциал. Находящийся с ним в паре ион, одинаковый по знаку с зарядом противоионов, способен сжимать ДЭС. При малых концентрациях действует первый фактор. При больших концентрациях, когда достройка кристаллической решетки завершена, превалирует второй фак- тор. Поэтому при введении в систему неиндифферентного электролита ζ-потенциал сначала будет возрастать, а потом падать, проходя через максимум. КCl - Увеличивает ионную силу.
Билет 4 1. Смачивание и растекание: В гетерогенных системах различают два типа межмолекулярного взаимодействия: внутрифазное и межфазное. Притяжение атомов и молекул внутри отдельной фазы называют когезией. Именно она определяет возможность существования веществ в конденсированном состоянии. К межфазным взаимодействиям относятся понятия адгезии, смачивания и растекания. Адгезия (прилипание) – взаимодействие между приведенными в контакт поверхностями конденсированных фаз разной природы. Адгезия обеспечивается физическими или химическими силами взаимодействия. Смачивание и растекание – это адгезионные взаимодействия между жидким и твердым телом. Явления адгезии и смачивания широко распространены в природе и технологических процессах: склеивание различных материалов, нанесение лаков, красок, металлических покрытий, печать, крашение тканей, изготовление различных материалов на основе связующих веществ.
Схема, иллюстрирующая понятия когезии (а) и адгезии (б). Количественные характеристики адгезионных процессов: Чтобы разорвать столбик жидкости с образованием двух новых поверхностей раздела (см. схему а), необходимо затратить работу, которая равна работе когезии, но противоположна по знаку: W разр = –W к; W к = 2σ12. Изменение энергии Гиббса в этом процессе: ∆ G к = ∆ G кон – ∆ G нач = σ12 + σ12 – 0 = 2σ12; W разр = – ∆ G к. Работа, затрачиваемая на разрыв поверхностного слоя на схеме б будет равна работе адгезии с обратным знаком: W разр = –W а = – ∆ G а, где ∆ G – изменение энергии Гиббса в процессе разрушения адгезионного слоя. Изменение энергии Гиббса в этом процессе: ∆ G нач = σ13; ∆ G кон = σ32 + σ12 – σ13; ∆ G а = ∆ G кон – ∆ G нач = σ32 + σ12 – σ13; W а = σ32 + σ12 – σ13 – уравнение Дюпре. Закон Юнга. Уравнение, выражающее взаимосвязь работы когезии, поверхностного натяжения и краевого угла смачивания. Это уравнение называется уравнением Юнга-Дюпре:
Оно позволяет выразить термодинамические условия смачивания через соотношения работ когезии и адгезии. Несмачиванию отвечает условие ½ W а < W к, смачиванию ½ W к < W а < W к, растеканию жидкости по твердому телу W а > W к закономерности смачивания выполняются не на всех поверхностях, а только на идеально гладких и однородных. Реально же твердые тела всегда имеют неоднородности, от которых зависит краевой угол смачивания, и которые затрудняют определение краевых углов.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 335; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.013 с.) |

 , соответствующая бесконечно малой концентрации вещества c, взятая с обратным знаком и полученная при постоянных значениях температуры и давления, называется поверхностной активностью (g):
, соответствующая бесконечно малой концентрации вещества c, взятая с обратным знаком и полученная при постоянных значениях температуры и давления, называется поверхностной активностью (g): 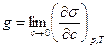 .
. Графически поверхностная активность может быть получена из изотермы поверхностного натяжения. Для этого к участку кривой, отвечающей минимальной концентрации растворенного вещества, проводится касательная до пересечения с осями.
Графически поверхностная активность может быть получена из изотермы поверхностного натяжения. Для этого к участку кривой, отвечающей минимальной концентрации растворенного вещества, проводится касательная до пересечения с осями.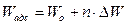 , где W0 – работа по переносу полярной части; ∆W – работа по переносу одной СН2-группы; n – число групп СН2.
, где W0 – работа по переносу полярной части; ∆W – работа по переносу одной СН2-группы; n – число групп СН2. , где cv – равновесная концентрация в объеме.
, где cv – равновесная концентрация в объеме.
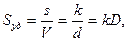
 (8)
(8)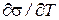 (p = const) всегда отрицателен. В области температур, далеких от критической, и, главным образом, для неассоциированных жидкостей σ изменяется с температурой линейно, и
(p = const) всегда отрицателен. В области температур, далеких от критической, и, главным образом, для неассоциированных жидкостей σ изменяется с температурой линейно, и 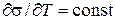 . У. Рамзай и П. Шильс для зависимости поверхностного натяжения от температуры приводят эмпирическое уравнение
. У. Рамзай и П. Шильс для зависимости поверхностного натяжения от температуры приводят эмпирическое уравнение , (1.11)
, (1.11) .
.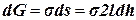 (коэффициент 2 учитывает двусторонность пленки).
(коэффициент 2 учитывает двусторонность пленки). , получаем:
, получаем: 
 .
.

 .
.


