Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дайте определение поверхностной активности и поясните выражение «понятие поверхностной активности относительно». Как экспериментально оценить поверхностную активность?Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Поверхностная активность – способность вещества понижать поверхностное натяжение данной границы раздела фаз. Эту способность характеризует производная
Из вышеперечисленного следует, что понятие поверхностной активности – относительно. Поверхностную активность обычно измеряют графически. А именно: к изоторме поверхностного натяжения через ее начальную точку проводят касательную. Тангенс угла α выражается отношением катетов ОА и ОВ, взятых в единицах σ и с, численно равен величине поверхностной активности.
4. Изобразите седиментационные кривые для моно- и полидисперсной водных суспензий сульфата бария, полученные в случае, если экспериментатор находился в а)лаборатории, б)кабине космического корабля. Наиболее распространенный и простой метод определения размеров частиц и функции распределения их по размерам является седиментационный анализ, основанный на различии скоростей оседания в поле силы тяжести частиц разного размера. а) в лаборатории
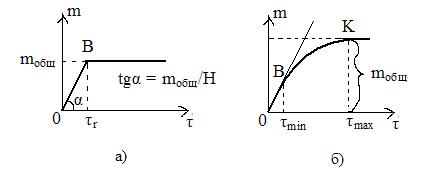
где – m – масса осевшего в-ва, mобщ – общая масса дисперсной фазы, H –первоначальная высота столба суспензии, t - время осаждения, mобщ/Н - масса дисперсной фазы в объеме, приходящаяся на единицу высоты столба суспензии. →
Рис.1 Седиментационные кривые получ в лаборатории для а) моно-, б)полидисперсных систем. Для полидисперсной системы график – кривая плавная линия. По времени tmin рассчитывается rmax – радиус самых крупных частиц, по времени tmax рассчитывается rmin – радиус самых мелких частиц. Ордината этой касательной соответствует массе всех выпавших частиц (mобщ).
б) кабине космического корабля ? Сила тяжести в космосе = 0. 5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А (NaCl), В (KH2SbO4), С (NaH2SbO4). NaCl+ KH2SbO4= NaH2SbO4+KCl Избыток NaCl: {m[NaH2SbO4]*nNa+*(n-x)Cl-}x+*xCl- Избыток KH2SbO4: {m[NaH2SbO4]*nH2SbO4*(n-x)K+}x-*xK+ 6. Назовите среди следующих электролитов K2SO4, Mg(NO3)2, AlCl3, Na3PO4 те, которым соответствует наибольший и наименьший пороги коагуляции золя ZnS, стабилизированного Na2S. Изобразите графически, как эти элетролиты влияют на ζ-потенциал. Наименьшая концентрация электролита, вызывающая коагуляцию за определённый короткий промежуток времени - порог коагуляции. Коагулирующая способность солей определяется ионом, имеющим знак заряда, противоположный знаку заряда коллоидной частицы и порог коагуляции очень быстро падает с увеличением валентности иона (правило Шульце-Гарди): Ck=const/z6, где Ск - концентрация электролита, вызывающая порог коагуляции; z – заряд противоиона. У ионов одинаковой валентности порог коагуляции снижается с увеличением объёма ионов. Ионы трёхвалентных металлов при добавлении их к золю во все возрастающих концентрациях ведут себя особым образом: видно из рис. 2, по мере возрастания концентрации электролита вначале имеет место резкое падение отрицательного значения ζ-потенциала, исчезновение потенциала в 0 точке, а затем изменение знака заряда, сопровождающееся сначала повышением положительного значения ζ-потенциала, а затем его понижением при дальнейшем увеличении концентрации электролита. Такое чередование коагуляции с её отсутствием и получило наименование «неправильных рядов». {m[ZnS]*nS2-*2(n-x)Na+}2x-*2xNa+ - отрицательно заряженная колл частица. По мере уменьшения порога коагуляции: Na+>K+>Mg2+. Al3+ - неправильный ряд.
Билет 5
|
|||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 742; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.125.181 (0.008 с.) |

 при Т,р=const которая изменяется с изменением концентрации. Физический смысл производной: понижение поверхностного натяжения раствора при изменении концентрации ПАВ на единицу. Количественной мерой поверхностной активности является величина g, т.е. мерой поверхностной активности является max значение производной.
при Т,р=const которая изменяется с изменением концентрации. Физический смысл производной: понижение поверхностного натяжения раствора при изменении концентрации ПАВ на единицу. Количественной мерой поверхностной активности является величина g, т.е. мерой поверхностной активности является max значение производной. . [ g ]=[Дж*м/моль]=[Н*м2/моль]
. [ g ]=[Дж*м/моль]=[Н*м2/моль]
 , где – r – радиус частицы, r - плотность ДФ, r0 – плотность жидкости (ДС), g – ускорение свободного падения, h - вязкость жидкости, Uсед – скорость движения частицы.
, где – r – радиус частицы, r - плотность ДФ, r0 – плотность жидкости (ДС), g – ускорение свободного падения, h - вязкость жидкости, Uсед – скорость движения частицы. - это уравнение описывает кинетику седиментации монодисперсных систем. Графически зависимость представлена на рис.1,а). Точке B соответствует окончание процесса седиментации, и в последующие моменты времени масса осевших частиц не изменяется. Тангенс угла наклона прямой характеризует скорость оседания частиц дисперсной фазы
- это уравнение описывает кинетику седиментации монодисперсных систем. Графически зависимость представлена на рис.1,а). Точке B соответствует окончание процесса седиментации, и в последующие моменты времени масса осевших частиц не изменяется. Тангенс угла наклона прямой характеризует скорость оседания частиц дисперсной фазы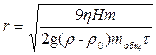 , при t = tr и m = mобщ ,
, при t = tr и m = mобщ ,  .
.