
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция. Зависимость от параметров системыСодержание книги
Поиск на нашем сайте
К явлениям, способствующим уменьшению σ относят: Адсорбция – это процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемом фазы. Может быть только во многокомпонентной системе. Перераспределяться в первую очередь будет компонент, у которого максимально маленькая σ. Адсорбент – вещество, на поверхности которого происходит адсорбция. Адсорбат – вещество, которое перераспределяется. Десорбция – процесс обратный адсорбции (т.е. переход в объем среды). Различают адсорбцию газов на «т» и «ж», растворенных веществ на поверхности твердых и жидких тел. Единицы измерения – число молей или массы на единицу поверхности объема или массы адсорбента: моль/м2, моль/кг, моль/м3, кг/м2, кг/кг, кг/м3. Различают также гиббсовскую адсорбцию – это избыточное количество вещества в поверхностном слое по сравнению с его количеством в объеме фазы. Единицы измерения: моль/м2, кг/м2.
Адсорбция зависит от T, p, c перераспределенного вещества, а также физико-химического сродства адсорбента и адсорбата (селективности). При адсорбции одного и того же вещества
Зависимость Зависимость Т.к. проще всего сделать const – T чаще всего адсорбцию описывают изотермой. Типы адсорбции Согласно физико-химической классификации различают: 1) Физическая адсорбция (молекулярная) 2) Хемосорбция (химическое присоединение атомов и молекул) 3) Ионный обмен Физическая адсорбция реализуется сил Ван-дер-Вальса. Они включают силы Франца, Лондона, создают дисперсионный эффект. За счет флуктуаций эмбрион плотностей соседних атомов – 65-70% вклад. - силы Кеезома, создают ориентационный эффект при деполь-депольном взаимодействии полярных молекул – 25-30% - силы Дебая, создают индукционный эффект за счет индуцирования деполя в неполярной молекуле при взаимодействии ее с полярной – 5% Для всех 3х составляющих выполняется закон изменения энергии от расстояния.
с – const, своя для каждого эффекта; m ≈ 12. Полная потенциальная энергия взаимодействия двух атомов:
При адсорбции идет взаимодействие адсорбируемого атома со многими атомами вещества. С учетом способности адс. взаимодействий к аддитивности после математических операций получим:
Вывод: 2. Чем больше атомов в молекуле, тем лучше адсорбция, т.к.
Хемосорбция – обусловлена силами химической природы (ионное взаимодействие, образование ковалентных, водородных связей). При этом может теряться индивидуальность исходных компонентов.
Четкой границы между физической адсорбцией и хемосорбцией нет. Физическая адсорбция может предшествовать хемосорбции. Один и тот же Адсорбат может адсорбироваться по различному механизму в зависимости от условий. Адсорбция О2 на угле.
Десорбция уже СО или СО2
Отличия физической адсорбции от хемосорбции не вникая в механизм взаимодействия: ü величина ü универсальность и слабая специфичность физической адсорбции по сравнению с хемосорбцией ü обратимость физической адсорбции ü характер температурной зависимости Ионный обмен Эквивалентный обмен ионов адсорбата на ионы того же знака адсорбента называется ионным обменом. Проявляется в гетерогенной системе т-ж, ж-ж, когда из жидкой фазы могут не переходить ионы в твёрдую фазу или другую не смешивающую жидкость. Суть ионного обмена в эквивалентном обмене. Адсорбенты способные к такому обмену называются ионообменниками или ионитами. Они находят большое применение. Их классифицируют: - на природные (торф, почвы гидроокиси металлов) и синтетические (ионообменные смолы, цеолиты, феррцианиты и тд.) - по составу: на органические (ионообменные смолы и тд.) и неорганические (сульфиды силикаты) - по знаку заряда обменных ионов на катиониты (КУ-2), аниониты (АВ-17, АН-31), амфолиты (АНКБ-34), гидроокиси металлов (ЭДЭ-10П) Механизм адсорбции на катионите может быть. R-COO-H + Na+ → R-COONa + H+ Адсорбция идёт на функциональных группах. Используется в металлургии, извлечении ценных компонентов, очистки воды, крови и тд. Особенности ионного обмена 1. Эквивалентность обмена 2. Адсорбция заряженных частиц (ионы, радикалы) 3. Неуниверсальный характер 4. Наличие рядов селективности Лиотропный ряд Na+<K+<Rb+<Cs+ Электроселективный ряд Fe3+>Ca2+>Na+ Ёмкость ионита по адсорбционным ионам определяется как COE или DOE, выражается мг-экв/г, мг-экв/см3, или мг/г, мг/см3. COE до 10-12мг-экв/г. Важные характеристики: 1. ёмкость 2. селективность 4. способность к регенерации Метод разделения основан на различие в адсорбции веществ некоторыми адсорбентами называется хроматографией.
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |


 ;
;  - называется изотермой.
- называется изотермой.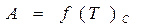 ;
;  - изопикна, изобара.
- изопикна, изобара. ;
;  - изостера.
- изостера. ,
,  ;
;
 , т.к. получили вместо 6 степени 3 можно сказать, что адсорбционные силы имеют более дальнодействующий характер:
, т.к. получили вместо 6 степени 3 можно сказать, что адсорбционные силы имеют более дальнодействующий характер: , n – число атомов, с которыми идет взаимодействие.
, n – число атомов, с которыми идет взаимодействие. .
. выше в несколько раз.
выше в несколько раз.

 - физическая адсорбция.
- физическая адсорбция.
 - хемосорбция
- хемосорбция



