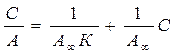Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фундаментальные адсорбционные уравнения ГиббсаСодержание книги
Поиск на нашем сайте
Из объединённого уравнения I и II начал термодинамики изменение полной внутренней энергии межфазной поверхности может быть записано в виде
Полный дифференциал:
т.к. при адсорбции происходит превращение поверхностной энергии в химическую, то при полном превращении можно записать
Определяет связь поверхностной энергии с химической. Здесь Гi – Гиббсовская адсорбция, т.е. поверхностный избыток адсорбата на поверхности по сравнению с объёмом. Фундаментальное адсорбционное уравнение Гиббса использовать неудобно, т.к.
Для системы где ai ≈ci
Для газов Адсорбция на границе ж-г При растворении вещества в жидкости возможно 1. растворённое вещество не меняет σ-сахар 2. растворённое вещество увеличивает σ –неорганические электролиты 3. растворённое вещество уменьшает σ – органические вещества Вещества, которые увеличивают σ называются инактивными Вещества, которые уменьшают σ называются ПАВ В адсорбционном уравнении Гиббса для растворенных веществ
Влияние природы вещества на адсорбцию отражает dσ/dc. Она определяет знак Г. Величина Физический смысл – это сила удерживающая вещество на поверхности и рассчитанная на единицу Гиббсовской адсорбции. Единица измерения: Н*м2/моль; Дж*м/моль. g=-tgα касательной к кривой σ = f(с) в точке пересечения её с осью ординат Если g>0 g<0 Толщина насыщенного адсорбционного слоя Обычно h совпадает с длинной правильно ориентированной в ней молекулы адсорбированного вещества. Насыщенный адсорбционный слой представляет собой сплошной “молекулярный ковёр” адсорбционного вещества. Уравнение Шишковского Большинство органических веществ являются ПАВ. Все они имеют дифильное строение: 1. по типу гидрофильных групп различают ионогенные и неионогенные ПАВ (жирные кислоты) ионогенные: - анионные карбоновые кислоты и их соли, стеарат Na: C17H35COONa, олеат Na: C17H33COONa - катионные соли алифатических и ароматических аминов - амфолитные (в зависимости от pH проявляют катионные или анионные, активные свойства, т.е. имеют –COOH или –NH2 группы) Поверхностная активность зависит от длины углеводородной цепи. Согласно правилу Дюкло-Трауба в гомологическом ряду жирных кислот при удлинение углеводородной цепи на 1 CH2 группу увеличивается g в 3-3,5 раза (3,2раз) Поверхностная активность вещества характеризуется также величиной ГЛБ (гидрофильно-липофильного баланса) – соотношение моль массы гидрофильной и гидрофобной групп. Согласно эмпирическим циклам Гриффита ГЛБ изменяется от 1 до 40, ТЭА – 12; олеат Na – 18, олеиновые кислоты 1 Переход ПАВ из истинно растворимого состояния в коллоидное характеризуется ККМ (критическая концентрация мицеллообразования). Это минимальная концентрация ПАВ, которая характеризует образование концентрированного раствора. Солюбилизация – включение внутрь мицеллы частиц. Поверхностная активность олеата Na (мыла) составляет ~ 4*107 Гиббс, т.е. на межфазной поверхности его концентрация не будет в 30 тыс.раз больше, чем в объёме, а значит концентрацией ПАВ в объеме можно пренебречь. Шишковским было введено эмпирическое уравнение, характеризующее изменение σ от концентрации ПАВ в растворе.
А, В – опытные константы В – константа для всего гомологического ряда А – константа изменения в соответствии с правилом Траубе. Потом это уравнение было выведено теоретически из предположения А=Г и обосновано физическим смыслом обеих констант. Комбинируя уравнение Гиббса с уравнением Шишковского для растворов жирных кислот
А – константа адсорбционного равновесия. Способность твердых адсорбентов поглощать газы и пары определяется состоянием и однородностью его поверхности и степенью пористости. Активность различных участков поверхности неоднородна. Так первые порции О2 на угле адсорбируются с
Получение пористых тел: 1) гидрозоль → коагуляция → сушка геля → дробления (d=0,1-7нм) так получают SiO2, Al2O3, MgO, цеолиты (0,4-1,1нм) 2) высокотемпературная активизация угля – сырца (торфа, костей) Т=700-900 ºС в атмосфере водяного пара, CO2 некоторых кислот (HCl, HNO3 и др) 3) Ni-гидрат выщелачивает Ni-Al сплавы. 5.5 Закон Генри (англ. уч. Уильям Генри 1836) Общим термодинамическим уравнением адсорбции является адсорбционное уравнение Гиббса, связывающее σ и μ.
Однако, рассмотрение адсорбции как процесса взаимодействия адсорбата с адсорбентом требует учета различных механизмов. Наиболее просто этот вопрос решается для систем «г-ж» и «ж-ж» в связи с энергетической однородностью поверхности жидкости. В этом случае активности отдельных участков адсорбционного поля практически выравниваются. Для твердых тел присутствует сильная неоднородность как геометрическая, так и эмпирическая. Пусть адсорбционный слой рассматривается как отдельная фаза:
Для объема
Эти уравнения выражают изотерму адсорбции в общем виде. Если с→0, то
Здесь КГ – const Генри При разбавлении системы адсорбция пропорциональна концентрации с коэффициентом пропорциональности КГ При разбавлении системы коэффициент распределения стремится к константе (КГ). Для газов С определенной концентрацией «со» начинается отклонение от закона Генри. Величина и знак отклонений определяется соотношением сил взаимодействия адсорбционных частиц между собой и с поверхностным слоем. Если взаимодействие частиц адсорбата с поверхностным слоем больше, чем между собой, то А возрастает и Д возрастает → «1» Изотерма адсорбции Ленгмюра (ам. уч. Ирвинг Ленгмюр, Нобел. Прем.) Фундаментальным вкладом в учение об адсорбции является изотерма Ленгмюра. Она позволяет учесть отклонения от закона Генри, связанные с ограниченной поверхности адсорбента. Вывод уравнения Ленгмюра базируется на трех постулатах: 1. Адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с 1 молекулой адсорбата, образуя мономолекулярный слой. 2. Адсорбционные центры энергетически эквипотенциальны, а поверхность эквипотенциальна. 3. Адсорбируемые молекулы не взаимодействуют друг с другом. Рассмотрим адсорбцию как квазихимическую реакцию
Для газов: К и КР характеризуют энергию взаимодействия адсорбата с адсорбентом (чем больше К, тем сильнее взаимодействие).
При С→0 Т.е. уравнение Ленгмюра является более общим соотношением, включающим в себя уравнение Генри. При больших С или Р КС>>1; Это отвечает насыщению адсорбата. Отсюда
Уравнение Ленгмюра очень часто решается Графически. Для этого оно приводится к линейной форме
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 843; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.241.235 (0.007 с.) |

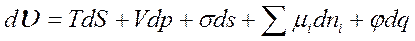
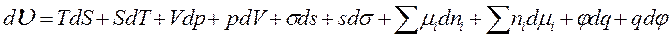 Пусть в системе происходит адсорбция “i” компонентов на межфазной поверхности при условии T, S, V, p, s, ni, q, φ –const, тогда
Пусть в системе происходит адсорбция “i” компонентов на межфазной поверхности при условии T, S, V, p, s, ni, q, φ –const, тогда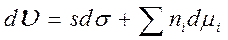 ,
,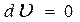 . Отсюда
. Отсюда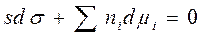 - уравнение Гиббса для межфазной поверхности
- уравнение Гиббса для межфазной поверхности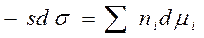
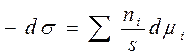 ;
; 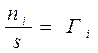
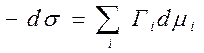 - фундаментальное адсорбционное уравнение Гиббса
- фундаментальное адсорбционное уравнение Гиббса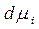 неизвестно. Пусть μ всех адсорбционных компонентов const, кроме одного, тогда:
неизвестно. Пусть μ всех адсорбционных компонентов const, кроме одного, тогда: 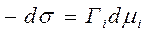 ,
, 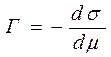 ;
;
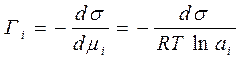
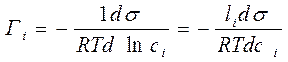
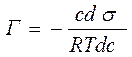 адсорбционное уравнение Гиббса для разбавленных растворов
адсорбционное уравнение Гиббса для разбавленных растворов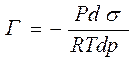
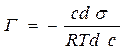
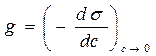 называется поверхностной активностью адсорбата (Ребиндер)
называется поверхностной активностью адсорбата (Ребиндер)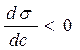 ,
, 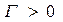
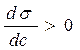 ,
, 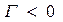 концентрация в объёме большая.
концентрация в объёме большая.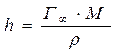
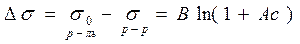
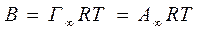
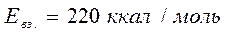 .
.

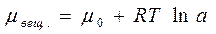
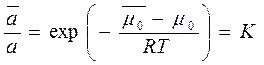 , где К – const, не зависящая от «с»
, где К – const, не зависящая от «с»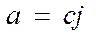 ;
; 
 ;
; 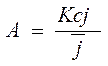
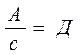 - коэф. распределения.
- коэф. распределения. 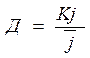
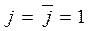
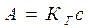 ;
;  - закон Генри
- закон Генри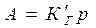
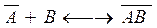
 - адсорбционный центр
- адсорбционный центр - Адсорбционный комплекс
- Адсорбционный комплекс ;
;  - величина адсорбции
- величина адсорбции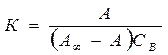 ;
;  - число адсорбционных центров
- число адсорбционных центров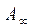 -емкость адсорбционного монослоя, число адсорбционных центров на ед. площади поверхности или массы
-емкость адсорбционного монослоя, число адсорбционных центров на ед. площади поверхности или массы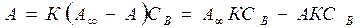
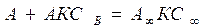
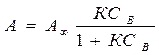 - уравнение изотермы Ленгмюра
- уравнение изотермы Ленгмюра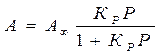
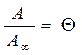 - степень заполнения поверхности адсорбента
- степень заполнения поверхности адсорбента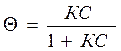
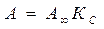 ;
; 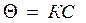 - изотерм Генри
- изотерм Генри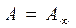 и
и 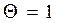
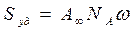
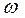 - площадь, занимаемая одной молекулой
- площадь, занимаемая одной молекулой