
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Селективная адсорбция из растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Может быть молекулярной и ионной. В отличие адсорбции из растворов от адсорбции из газовой фазы в том, что поверхность адсорбата полностью занята молекулами растворителя. Поэтому адсорбция идёт путём вытеснения с поверхности молекул растворителя. Присутствие в растворе двух компонентов приводит к конкурирующей адсорбции. Избирательность или селективность адсорбента к тому или иному адсорбату определяется величиной сродства компонента к поверхности адсорбента. Избирательность адсорбента зависит от физико-химической природы адсорбата и растворителя. Чем хуже адсорбционный растворитель. Тем лучшее будет адсорбируемое растворимое вещество растворитель адсорбируется тем хуже, чем больше σ. Отсюда: 1. адсорбция лучше из водных растворов; чем из органических 2. чем лучше растворитель растворяет вещество, тем хуже оно адсорбируется из раствора (правило Шилова). Экспериментально установлено, что неполярные твёрдые тела лучше адсорбирую не полярные адсорбаты и наоборот. Согласно правилу уравнивания полярности Ребиндера – процесс адсорбции идёт в сторону уравнивания полярности фаз и тем сильнее, чем больше разность полярностей исходных веществ. Так адсорбция ПАВ (моющее средство) на синтетических тканях выше, чем на хлопчатобумажных, т.к.
- С увеличением молярной массы вещества адсорбция увеличивается (ферментативный катализ – сложные органические молекулы адсорбируются на ферментах, разлагаются и их мелкие фрагменты уже неконкурентоспособны с крупными молекулами) - Ароматические соединения адсорбируется лучше алифатических - Непредельные органические соединения адсорбируются лучше предельных - Адсорбция увеличивается в 3,0-3,5 раза при удлинении углеводородной цепи на 1 звено (не для мелкопористых адсорбентов) Увеличение t-ры уменьшает адсорбцию. Еще более сложны закономерности ионной адсорбции. ü Адсорбируются заряженные частицы (ионы, катионы) ü Адсорбция только на полярных адсорбентах ü Адсорбция сопровождается образованием ДЭС ü Выражена избирательность (катионы, анионы) ü Кинетически необратима (химическая природа) ü Наличие рядов селективности (радов Гофмейстера) Li+<Na+<K+; Th4+>>Al3+>>Ca2+>>K+ Коэффициент распределения: Коэффициент разделения: Распределение масс распределяемых веществ между фазами характеризует степени извлечения
Электрокинетические явления 1809 Рейс (московский профессор), Фердинанд Фридрих (немец). Явление перемещения жидкости в пористых телах под действием электрического поля называется электроосмосом. Явление перемещение частиц дисперсной фазы в электрическом поле называется электрофорезом (частицы имеют заряд противоположный жидкости)
1859г. Квинке показал, что серц. Явление обратное электроосмосу, т.е. при течение жидкости через пористое тело под давлением возникает разность потенциалов. Явление называется потенциалотечение или протекание. Наблюдается при продавливании жидкости через дерево, глину, песок, графит и тд.
1887г. Дорн измерил
Таким образом электрокинетические явления по причинно следственным признакам делят на 2 группы: 1. электроосмос, электрофорез – движение фаз вызывается 2. потенциалотечение и потенциалоседиментации – движение фаз вызывают Причина электрокинетических явлений в наличии на границе фаз ДЭС. При движении фаз происходит разрыв ДЭС по плоскости скольжения, которая проходит через диффузный слой. В результате дисперсная среда и фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения, называется ξ – потенциалом или электрокинетическим потенциалом. ξ всегда меньше потенциала диффузного слоя. Величина ξ зависит от природы фаз, Т, ε, Z, η и может составлять 100 мВ и больше (оксиды). Электроосмос Линейная скорость:
L – расстояние между электродами
I – сила тока, R – сопротивление
это приращение проводимости в растворе за счет ДЭС, если диаметры капилляров велики Электрофорез Подвижность:
В разбавленных растворах при 20 ºС:
с – концентрация суспензии; S – поверхность электродов. Уравнение Гельмгольца-Смоулховского для ξ – потенциала через потенциал течения имеет вид:
Е – напряжение поля, возникающее при седиментации.
Потенциал течения и потенциалседиментации могут являться причиной взрывов и пожаров при перекачке топлива, технологических растворов, осаждении суспензий и эмульсий в связи с возникновением высоких
Практическое использование: электроосмос – осушка различных объектов (стен зданий, сыпучих материалов, при строительстве плотин, дамб), электроды – полые трубы с отверстиями → откачка, фильтрация – трудно фильтруемых сред электрофорез – в авто и электронной промышленности нанесение покрытий равномерно на детали сложной формы. 1й электрод – деталь, 2й электрод – емкость с суспензией. Анодофарез и катодофарез – деталь. Медицина – фракционирование полимеров.
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 878; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.009 с.) |

 , (отстирывается синтетика лучше)
, (отстирывается синтетика лучше) .
.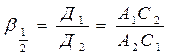 , показывает, во сколько раз отношение величин адсорбции разделяемых компонентов больше отношения их концентрации в объеме.
, показывает, во сколько раз отношение величин адсорбции разделяемых компонентов больше отношения их концентрации в объеме. и разделения
и разделения 
 ;
; 
 ~
~  .
. при седиментации частиц кварца в центробежном поле, т.е. открыл явление обратное электрофорезу – возникновение
при седиментации частиц кварца в центробежном поле, т.е. открыл явление обратное электрофорезу – возникновение 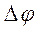 при осаждении дисперсной фазы получила название потенциалоседиментации или осаждения (эффект Дорна).
при осаждении дисперсной фазы получила название потенциалоседиментации или осаждения (эффект Дорна).

 - уравнение Гельмгольца-Смоулховского.
- уравнение Гельмгольца-Смоулховского.
 - электроосмотическая подвижность [м2/сВ]
- электроосмотическая подвижность [м2/сВ]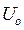 через объемную скорость можно выразить как
через объемную скорость можно выразить как  , где S – поперечное сечение в капилляре.
, где S – поперечное сечение в капилляре.
 ;
;  ;
; ;
; 
 - Δφ
- Δφ - удельная объемная электропроводность
- удельная объемная электропроводность - поверхностная проводимость
- поверхностная проводимость - коэф. эффективности диафрагмы
- коэф. эффективности диафрагмы
 ;
; ;
; ;
;
 - число частиц в единице объема;
- число частиц в единице объема;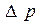 заменится на
заменится на  .
. .
.


