
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фазовое равновесие при адсорбции.Содержание книги
Поиск на нашем сайте
Равновесие при адсорбции характеризуется зависимостями количества вещества, поглощённого единицей массы или объёма данного адсорбента, от температуры и концентрации поглощаемого вещества в парогазовой смеси (раствор). Зависимость между равномерными концентрациями фаз при адсорбции
Содержание
Зависимости Содержание Типы изотерм адсорбции. Изотерма адсорбции является источником информации о структуре адсорбента, тепловом эффекте адсорбции и других характеристиках процесса.
Рис.8-1.Типы изотерм адсорбции (I-V): а – величина адсорбции (количество поглощённого вещества) кг/м3; р – парциальное давление пара адсорбата; рs – парциальное давление насыщенного пара адсорбата Выделяют пять основных типов изотерм адсорбции (рис. 8-1). Тип 𝐼 характерен для микропористых сорбентов. Начальные выпуклые участки изотерм типов 𝐼𝐼 и 𝐼𝑉 указывают на присутствие вместе с макропорами некоторого объёма микропор. Начальные вогнутые участки изотерм типов 𝐼𝐼𝐼 и 𝑉 указывают, что взаимодействие молекул адсорбата с адсорбентом значительно меньше межмолекулярного взаимодействия для молекул адсорбата. Отличие 𝐼𝐼 от 𝐼𝑉 и 𝐼𝐼𝐼 от 𝑉 в том, что объём переходных пор (𝐼𝑉 и 𝑉 типы)заполняются адсорбатом раньше, чем относительное давление
Если представить типичную изотерму адсорбции в виде кривой в координатах
Уравнение Фрейндлиха хотя и применимо для практических расчётов в широком диапазоне давлений, однако имеет большую погрешность при малых значениях Процесс физической адсорбции лучше описывается уравнением Ленгмюра:
Уравнение Ленгмюра удовлетворительно описывает экспериментальные данные только для изотерм типа 𝐼, однако его часто используют для расчётов кинетики адсорбции. Располагая изотермой адсорбции пара стандартного вещества для температуры
При расчёте точек изотермы исследуемого пара координаты Активность адсорбента. Способность адсорбента поглощать вещество называют активностью. Активность адсорбента может быть статической и динамической. Статическая активность (или равновесная)
Динамическая активность Момент проскока – это момент обнаружения поглощаемого вещества в выходящем из адсорбера потоке газа. Проскок начинается после некоторого времени работы адсорбера, когда его поверхность уже будет в какой-то мере насыщена поглощаемым веществом. Активность адсорбента зависит от температуры и концентрации в нём поглощаемого вещества, динамическая активность всегда меньше статической (
|
||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 706; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.33.239 (0.007 с.) |

 , (8-1) при постоянной температуре примет вид
, (8-1) при постоянной температуре примет вид (8-2) где
(8-2) где  - относительная массовая доля поглощаемого компонента в адсорбенте, равновесная с концентрацией адсорбтива в газовой (жидкой) фазе,
- относительная массовая доля поглощаемого компонента в адсорбенте, равновесная с концентрацией адсорбтива в газовой (жидкой) фазе,  ;
;  - относительная массовая доля адсорбтива в фазе, из которой поглощается вещество,
- относительная массовая доля адсорбтива в фазе, из которой поглощается вещество,  .
. , (8-3)
, (8-3) может быть заменено величиной адсорбции «𝑎»
может быть заменено величиной адсорбции «𝑎»  , а содержание
, а содержание  парциальным давлением 𝑝 в парогазовой смеси.
парциальным давлением 𝑝 в парогазовой смеси.
 приблизится к 𝐼 (в результате капиллярной конденсации). При этом на изотермах появляется верхний участок, близкий к горизонтальному. 𝐼𝐼𝐼 и 𝑉 встречаются редко.
приблизится к 𝐼 (в результате капиллярной конденсации). При этом на изотермах появляется верхний участок, близкий к горизонтальному. 𝐼𝐼𝐼 и 𝑉 встречаются редко. (рис. 8-2), то на ней в начале наблюдается почти прямая пропорциональность между 𝑝 и
(рис. 8-2), то на ней в начале наблюдается почти прямая пропорциональность между 𝑝 и  (состояние насыщения). В средней части кривую можно описать эмпирическим уравнением Фрейндлиха:
(состояние насыщения). В средней части кривую можно описать эмпирическим уравнением Фрейндлиха: или
или  , (8-4) где
, (8-4) где  и П – константы определяемые экспериментально.
и П – константы определяемые экспериментально.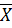 и при
и при  , (8-5)
, (8-5) , можно определить изотерму адсорбции другого пара при температуре
, можно определить изотерму адсорбции другого пара при температуре  . Для определения величин адсорбции используют формулу:
. Для определения величин адсорбции используют формулу: , (8-6) где
, (8-6) где  - ордината изотермы адсорбции стандартного вещества (обычно бензола),
- ордината изотермы адсорбции стандартного вещества (обычно бензола),  или
или  ;
;  - ордината определяемой изотермы,
- ордината определяемой изотермы,  и
и  - мольные объёмы стандартного и исследуемого вещества (в жидком состоянии),
- мольные объёмы стандартного и исследуемого вещества (в жидком состоянии),  ; (8-7) здесь
; (8-7) здесь  и
и  - парциальные давления стандартного и исследуемого вещества, мм. рт. ст.;
- парциальные давления стандартного и исследуемого вещества, мм. рт. ст.;  и
и  - давление насыщенного пара стандартного и исследуемого вещества при температурах
- давление насыщенного пара стандартного и исследуемого вещества при температурах  и
и  , мм. рт. ст.;
, мм. рт. ст.;  - коэффициент аффиности (сродства), равный отношению мольных объёмов:
- коэффициент аффиности (сродства), равный отношению мольных объёмов: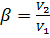 , (8-8)
, (8-8)
 (или
(или  ) – это количество адсорбируемого вещества, которое поглощается к моменту достижения равновесия единицей массы или объёма адсорбента при данной температуре и концентрации адсорбтива в газе (жидкости) – носителе (в неподвижных условиях).
) – это количество адсорбируемого вещества, которое поглощается к моменту достижения равновесия единицей массы или объёма адсорбента при данной температуре и концентрации адсорбтива в газе (жидкости) – носителе (в неподвижных условиях). - это количество адсорбируемого вещества, поглощаемого единицей массы или объёма адсорбента при пропускании через него газа или жидкости (содержащих адсорбтив), до начала проскока.
- это количество адсорбируемого вещества, поглощаемого единицей массы или объёма адсорбента при пропускании через него газа или жидкости (содержащих адсорбтив), до начала проскока. ). Расход адсорбента на установку определяют по динамической активности адсорбента
). Расход адсорбента на установку определяют по динамической активности адсорбента  ).
).


