
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод теоретических ступеней изменения концентраций (теоретических тарелок).Содержание книги
Поиск на нашем сайте
Построение теоретических ступеней изменения концентрации показано на рис.5-11 Из точки М (с координатами ун, хн) проводится отрезок МС до пересечения с линией равновесия, затем отрезок СА до пересечения с рабочей линией. Ступенька АСМ изображает изменение составов обеих фаз на теоретической тарелке. Для нее у2 и хк равновесны друг другу (точка С) или у2 равно Строя последовательно подобные ступеньки до пересечения с ординатой, отвечающей составу газа, удаляющегося с верхней (последней) теоретической ступени, находят число теоретических ступеней nc. Для перехода от числа теоретических ступеней к числу действительных тарелок используют соотношение:
где η – средний по всей высоте колонки КПД, учитывающий реальную кинетику массообмена; обычно η=0,3÷0,8. Рабочую высоту тарельчатых аппаратов Н (расстояние между крайними тарелками) определяют как Диаметр аппарата рассчитывают по уравнению расхода для газовой фазы
Величина V обычно задается;
VI Массообмен в процессе абсорбции. Общие сведения. Физические основы процесса. Абсорбция – это процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидким поглотителем (абсорбентом). При физической абсорбции поглощаемый компонент не взаимодействует химически с абсорбентом. Процесс в большинстве случаев обратим. На этом свойстве основано выделение поглощённого компонента из раствора – десорбция. Если поглощаемый компонент образует с абсорбентом химическое соединение, то процесс называют хемосорбцией. В промышленности процесс абсорбции обычно сочетают с десорбцией, что позволяет многократно использовать абсорбент. Примерами использования процессов абсорбции в промышленности могут служить: а) разделение углеводородных газов на нефтеперерабатывающих установках; б) получение соляной и серной кислот, аммиачной воды; в) очистка газовых выбросов от вредных примесей; г) выделение ценных компонентов из газов крекинга или пиролиза метана, из газов коксовых печей и т.д. Абсорбенты выбирают по растворимости в них поглощаемых компонентов. Растворимость газов в жидких поглотителях зависит: 1) от физических и химических свойств газовой и жидкой фаз; 2) от температуры; 3) от давления газа в смеси. Статика процесса абсорбции. Равновесие между фазами определяется правилом фаз Гиббсона: число параметров (или ступеней свободы) С процесса равно числу компонентов К минус число фаз Ф плюс 2: С = К – Ф + 2 (6-1) Процесс абсорбции осуществляется в двухфазной (газ – жидкость) трёхкомпонентной системе. Согласно правилу фаз - С = К – Ф + 2 = 3 – 2 + 2 = 3. Следовательно, не нарушая равновесия в системе, можно варьировать тремя её параметрами (например, температурой, давлением и составом одной из фаз) В двухфазных системах газ – жидкость равновесие выражается в виде фазовых диаграмм состав-состав или состав-свойство (например, состав-давление или состав-температура кипения). Для абсорбционно-десорбционных процессов равновесие между газами и их растворами в жидкости описывается законом Генри, по которому при данной температуре количество газа, растворяющегося в жидкости, прямо пропорционально давлению газа над ней:
При практических расчётах по значениям равновесного парциального давления газа Следовательно,
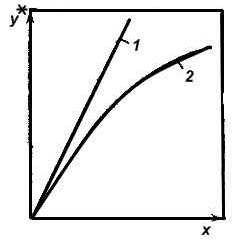
1 – для разбавленных растворов газа; 2 – для концентрированных растворов Рис.6.2.Рабочая и равновесная линии абсорбера: АВ – рабочая линия при расходе поглотителя L; АС – то же при Lмин ; начало координат – С – равновесная линия У*=f(x) Из закона Генри следует, что растворимость газа в жидкости увеличивается с повышением давления П и понижении температуры. Для понижения температуры охлаждают исходные газовую смесь и поглотитель, отводят теплоту, выделяющуюся в процессе абсорбции с помощью встроенных (внутренних) или наружных теплообменников. По данным о растворимости поглощаемых компонентов осуществляется выбор поглотителей (абсорбентов) - лучший поглотитель тот, у которого расход для процесса меньший. Кроме того, при выборе абсорбента оценивают такие свойства, как селективность (избирательность) к поглощаемому компоненту, токсичность, пожароопасность, стоимость, доступность и т.д. При оценке физико-химических свойств системы поглощаемый газ – поглотитель учитывают, что лучшим является тот абсорбент, в смеси с которым поглощаемый компонент имеет наименьший коэффициент активности
|
||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 555; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.170.253 (0.007 с.) |

 т.е. у2=у1*. Ступень изменения концентрации можно определять либо как элемент аппарата, в котором на выходе из этого элемента достигается содержание целевого компонента, равное равновесному на входе, либо как движущую силу процесса, которая обеспечивает содержание целевого компонента на выходе из элемента, равное равновесному на входе.
т.е. у2=у1*. Ступень изменения концентрации можно определять либо как элемент аппарата, в котором на выходе из этого элемента достигается содержание целевого компонента, равное равновесному на входе, либо как движущую силу процесса, которая обеспечивает содержание целевого компонента на выходе из элемента, равное равновесному на входе.
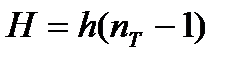 , где h – расстояние между тарелками.
, где h – расстояние между тарелками. , где V – объемный расход газа (пара); ω – фиктильная скорость, т.е. скорость, отнесенная к полному сечению аппарата; f – площадь поперечного сечения аппарата.
, где V – объемный расход газа (пара); ω – фиктильная скорость, т.е. скорость, отнесенная к полному сечению аппарата; f – площадь поперечного сечения аппарата.
 определяют по предельной скорости (
определяют по предельной скорости ( ), которая рассчитывается по справочным эмпирическим уравнения, а
), которая рассчитывается по справочным эмпирическим уравнения, а 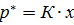 , (6-2) где
, (6-2) где  - равновесное парциальное давление растворённого газа; х – содержание растворённого газа в жидкости (в мольных долях или
- равновесное парциальное давление растворённого газа; х – содержание растворённого газа в жидкости (в мольных долях или  - поглотителя); К - константа Генри, зависящая от свойств растворённого газа и поглотителя, а также от температуры, имеет размерность давления.
- поглотителя); К - константа Генри, зависящая от свойств растворённого газа и поглотителя, а также от температуры, имеет размерность давления. , где Р – давление паров чистого компонента, определяемое по закону Рауля, как
, где Р – давление паров чистого компонента, определяемое по закону Рауля, как  ; П – общее давление газовой смеси.
; П – общее давление газовой смеси. , т.е. уравнение равновесия для процесса абсорбции при низкоконденсированных растворах газов представляет собой уравнение прямой линии
, т.е. уравнение равновесия для процесса абсорбции при низкоконденсированных растворах газов представляет собой уравнение прямой линии  с тангенсом угла наклона, равным
с тангенсом угла наклона, равным  , а отношение постоянных величин
, а отношение постоянных величин  – коэффициент распределения, постоянный для данной системы газ-жидкость при
– коэффициент распределения, постоянный для данной системы газ-жидкость при  и
и  (см. рис. 6-1).
(см. рис. 6-1).
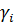 , т.е. те жидкости, которые составляют с поглощаемым компонентом системы с отрицательными отклонениями от идеального поведения
, т.е. те жидкости, которые составляют с поглощаемым компонентом системы с отрицательными отклонениями от идеального поведения  . Абсорбент должен обладать меньшей летучестью во избежание его больших потерь.
. Абсорбент должен обладать меньшей летучестью во избежание его больших потерь.


