
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження процесів адсорбційного очищення речовинСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
4.1 Мета роботи
Дослідити адсорбцію розчину оцтової кислоти активованим вугіллям. За одержаними даними побудувати ізотерму адсорбції і знайти для рівняння Фрейндліха значення постійних величин
4.2 Методичні вказівки з організації самостійної роботи студентів
Сорбцією(від латинського “sorbeo” – поглинати, втягувати) називається будь-який процес поглинання однієї речовини (сорбтива) іншою (сорбентом) незалежно від механізму поглинання. За механізмом розрізняють адсорбцію; абсорбцію та хемосорбцію. Адсорбцією називається зміна концентрації речовини на границі розділу фаз. Адсорбція відбувається на будь-яких міжфазних поверхнях, і адсорбуватися можуть будь-які речовини. Є випадки, коли поглинання однієї речовини іншою не обмежується поверхневим шаром, а відбувається в усьому
об’ємі сорбенту. Таке поглинання називається абсорбцією. Прикладом процесу абсорбції є розчинення газів у рідинах. Поглинання однієї речовини іншою, що супроводжується хімічними реакціями, називається хемосорбцією. Поверхневі явища, зокрема адсорбція, відіграють важливу роль у різних галузях техніки. Адсорбція змінює не тільки поверхневі, а й об’ємні властивості напівпровідникових матеріалів, впливає на роботу виходу електронів з поверхні твердих тіл. Процеси адсорбції та десорбції відбуваються при хімічному і електрохімічному травленні, поліруванні напівпровідників та металів, при очищенні поверхні твердих тіл від забруднення тощо. Адсорбція використо- вується для очищення газів та рідин, виділення залишків газів з вакуумних приладів, розділення та аналізу сумішей, витягування цінних речовин з відходів виробництва і т.д. Адсорбція називається позитивною, якщо вона призводить до підвищення концентрації речовини у граничному шарі, і негативною, якщо концентрація речовини зменшується. Позитивна адсорбція відбувається самостійно лише в тому випадку, коли при цьому процесі зменшується величина поверхневого натягу. Адсорбція речовин на поверхні твердих та рідких тіл відбувається завдяки неповній насиченості хімічних ван-дер-ваальсових сил у молекул і атомів (іонів), що знаходяться у поверхневих шарах, де кількість сусідніх часток завжди менша, ніж в об’ємі. Адсорбція залежить від природи адсорбенту та адсорбтиву, від концентрації розчинів, температури і тиску газу. Кількість речовини, що поглинається твердим адсорбентом, залежить також від площі його поверхні. Тому для здійснення адсорбційних процесів дуже важливим є створення високопористих адсорбентів з розвиненою внутрішньою поверхнею, яку характеризує питома поверхня, тобто поверхня 1г сорбенту. Найважливішими пористими сорбентами є активоване вугілля та силікагель. Сучасне активоване вугілля має розвинену систему пор і поверхню до 1000 м2/г. Вугілля є гідрофобним адсорбентом, тобто речовиною, що погано змочується водою. Воно адсорбує речовини, розчинені у воді. Гідрофільні адсорбенти (добре змочуються водою) поглинають водяну пару і речовини, розчинені у неполярних розчинниках – вуглеводневих рідинах. До таких сорбентів відносять силікагель, деякі типи алюмосилікатів тощо. Адсорбція зменшується з підвищенням температури. При постійній температурі залежність адсорбції від концентрації адсорбтиву описує рівняння Фрейндлиха:
X/m=a*C n, (4.1)
де Х – загальна кількість розчиненої речовини, що адсорбована адсорбентом масою m і знаходиться у рівновазі з розчином концентрації C; а та n – константи даного процесу, причому n<1.
Ізотерма адсорбції має такий вигляд (рис. 4.1 а):
а б
Рисунок 4.1 – Ізотерми адсорбції
Рівняння (4.1) після логарифмування має вигляд: lg X/m = lg a +n lg C. (4.2) Це рівняння прямої (рис. 4.1 б).
Для проведення дослідження адсорбції твердим адсорбентом розчиненої речовини треба мати 100-міліграмові ємності, технічні терези, рівноваги, бюретки на 25 мл, конічні колби на 250 мл, лійки, активоване вугілля, фарфорову ступку з товкачиком, механічний струшувач та допоміжні матеріали і реактиви.
4.4 Порядок виконання роботи і методичні вказівки до її виконання Розбавлянням 2н розчину оцтової кислоти готують в шістьох колбах розчин:
Таблиця 4.1 – Концентрація вихідних розчинів
Розчини готують так. В колбу №1 наливають 200 мл води, в інші по 100 мл. Потім в колбу 1 додають 50 мл початкового розчину кислоти, перемішують та відбирають 100 мл одержаного розчину приблизної концентрації 0,4 н в колбу №2. 100 мл одержаного розчину 0,2 н концентрації наливають в колбу №3 і одержують розчин 0,1 н і т.д. Поділ розчину виконують піпеткою. 50 мл кожного розчину переносять відповідно в склянки з пробками, при цьому номери склянок повинні відповідати номеру колби. Точний склад оцтової кислоти визнають титруванням 0,1 н розчином
Титрування кожного розчину проводять два - три рази і з одержаних результатів обчислюють середнє значення. Для проведення адсорбції в шість склянок, в яких міститься по 50 мл початкових розчинів, вносять по 2г активованого вугілля, зваженого на технічних терезах з точністю до сотих частин грама. Активоване вугілля треба спочатку розтерти у фарфоровій ступці товкачиком. Склянки старанно збовтують протягом 20 хв. на механічному струшувачу для установки адсорбційної рівноваги, а потім фільтрують вміст кожної склянки в окремі сухі склянки. Відібравши із фільтратів піпеткою проби в таких же кількостях, які були взяті для початкового титрування, визначають титрування кількість оцтової кислоти Титрування розчину оцтової кислоти до додавання вугілля дає її початкову концентрацію Підсумки наносять на графік: по осі абсцис відкладають значення C, а по осі ординат – значення X/ m, де
Т а б л и ц я 4.2 – Результати вимірювань та розрахунків
4.5 Контрольні запитання та завдання
1. Що таке адсорбція, абсорбція, сорбція, хемосорбція? Причини виникнення. 2. Що таке адсорбент, адсорбтив? Навести приклади. 3. Рівняння Фрейндліха та його аналіз. 4. В яких одиницях вимірюється адсорбція? 5. Напишіть рівняння Лангмюра, дайте його пояснення. 6. Напишіть рівняння Гіббса та поясніть його. 7. Значення адсорбції для електроніки.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 527; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.89.70 (0.007 с.) |

 і
і  .
.


 (індикатор фенолфталеїн), при цьому із колб №1 та №2 піпеткою відбирають по 5 мл, із колб №3 та№ 4 по 10 мл, із колб № 5 та №6 по 20 мл розчину.
(індикатор фенолфталеїн), при цьому із колб №1 та №2 піпеткою відбирають по 5 мл, із колб №3 та№ 4 по 10 мл, із колб № 5 та №6 по 20 мл розчину. , поглинутої двома грамами вугілля з 50 мл розчину. Значення
, поглинутої двома грамами вугілля з 50 мл розчину. Значення  , а титрування фільтрату – її концентрацію –
, а титрування фільтрату – її концентрацію –  . Після адсорбції Х =C- C1.
. Після адсорбції Х =C- C1. – вага вугілля (2 г). Отримана крива – це ізотерма адсорбції (рис. 4.1а). Для визначення постійних рівняння (4.2)
– вага вугілля (2 г). Отримана крива – це ізотерма адсорбції (рис. 4.1а). Для визначення постійних рівняння (4.2) 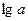 (рис. 4.1). Одержані дані занести до табл. 4.2.
(рис. 4.1). Одержані дані занести до табл. 4.2.





