
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вимірювання електрорушійної сили гальванічних елементівСодержание книги
Поиск на нашем сайте
5.1 Мета роботи Вивчити виникнення електродних потенціалів, набути практичні навички у складанні гальванічних елементів, розрахунку та вимірюванні електрорушійної сили, що виникає у реальних гальванічних елементах. 5.2 Методичні вказівки з організації самостійної роботи студентів
При всіх окислювально-відновних реакціях відбувається перехід електронів від відновника до окисника, тобто енергія хімічної реакції може перетворюватися на електричну. При зануренні металу у розчин електроліту, який містить його власні іони, іони металу Меn+ переходять із металевої фази в розчин і в розчину в метал. Енергетичний стан іонів у металі та в розчині різний, тому спочатку ці процеси ідуть із різною швидкістю. Якщо потенційна енергія іонів у металі вища, ніж у розчині, то переважає вихід іонів з металу, розчин набуває позитивного заряду, а металевий електрод – негативного. Через деякий час швидкість виходу катіонів у однойменно заряджений електроліт уповільнюється і між металом та розчином встановлюється рівновага. Якщо більша потенційна енергія іонів у розчині, то швидкість переходу катіонів в електроліт менша, ніж швидкість їх зворотного переходу. У цьому випадку між електродом і розчином також встановлюється рівновага, тільки позитивного заряду набуває метал, а негативного – електроліт. Незалежно від того, якого заряду набувають електрод та електроліт, між металом та розчином його солі встановлюється різниця потенціалів, яка називається електродним потенціалом металу. Величина електродного потенціалу залежить від природи металу, складу електроліту та деяких інших факторів. Виміряти абсолютну величину електродних потенціалів металів неможливо, тому значення електродних потенціалів визначають щодо електродів порівняння, потенціал яких відомий. Таким чином, електродний потенціал визначається щонайменше трьома окремими стрибками потенціалу: на границях досліджуваний метал – електроліт, досліджуваний метал – метал електрода порівняння, метал електрода порівняння – електроліт. Електродним потенціалом металу називають електрорушійну силу елемента, що складається з даного електрода та електрода порівняння. Якщо метал знаходиться у динамічній рівновазі з розчином власної солі, то електродний потенціал називають рівноважним. Його можна не тільки вимірю- вати, а й обчислити за рівнянням Нернста:
де φ0 – стандартний електродний потенціал металу Ме; T – температура процесу; n – заряд іону; R – універсальна газова постійна; F – число Фарадея; [OX], [Red] – активні концентрації іонів реагуючих речовин. При температурі 25о С (298 К) це рівняння має вигляд:
φ = φ0+ де φ° – стандартний електродний потенціал металу Ме; n – заряд іону металу. У випадку, коли електроліт містить не тільки власні іони металу, а й будь-які інші іони, найчастіше іони Н+1, утворюється нерівноважний потенціал. Обчислити такий потенціал неможливо, його можна лише виміряти. Величину і знак стандартного потенціалу металу визначають щодо нормального водневого електрода, потенціал якого вважають рівним нулю. Нормальний водневий електрод (рис. 5.1) – це платинова пластина, занурена в розчин сірчаної кислоти, молярна концентрація якого дорівнює 1 моль/л. Через цей розчин пропускають газоподібний водень під тиском 101325 Па.
Рисунок 5.1 – Нормальний водневий електрод
Різниця потенціалів між металом, зануреним у розчин його солі з молярною концентрацією солі 1 моль/л, і водневим електродом називається нормальним, або стандартним електродним потенціалом. Вимірюючи електродні потенціали металів, одержали ряд стандартних електродних потенціалів – електрохімічний ряд напруг, або ряд витіснення металів. За допомогою цього ряду можна визначити напрямок окислювально- відновних реакцій між окремими металами та їх іонами. Пристрої, що застосовують для безпосереднього перетворення енергії хімічних реакцій на електричну енергію, називають гальванічними елементами або хімічними джерелами електричної енергії (ХДЕЕ). В техніці гальванічними елементами називають тільки ті ХДЕЕ, в яких протікають практично необоротні реакції. ХДЕЕ, в яких відбуваються практично оборотні реакції, називають акумуляторами. Це пристрої багаторазового використання. Дія будь-якого гальванічного елемента заснована на протіканні в ньому окислювально-відновних реакцій. У найпростішому випадку гальванічний елемент складається з двох пластин, виготовлених із різних металів і занурених у розчин електроліту. Така система дає можливість просторово розділити окислювально-відновні реакції: окислення відбувається на одному електроді, а відновлення – на другому. Таким чином, електрони передаються від відновника до окисника по зовнішньому ланцюгу. Гальванічний елемент Якобі – Даніеля (рис. 5.2) складається з мідної пластини, зануреної у розчин сульфату міді (мідний електрод), та пластини з цинку, зануреної у розчин сульфату цинку (цинковий електрод). Обидва розчини стикаються один з одним, але для попередження змішування вони розділені перегородкою з пористого матеріалу. Схематично цей гальванічний елемент можна представити таким чином:
-Zn | ZnSO4 || CuSО4 | Cu+
Рисунок 5.2– Гальванічний елемент Якобі – Даніеля
У гальванічній парі метал із більш негативним потенціалом називається анодом, а більш позитивним – катодом. Таким чином, у даному гальванічному елементі анодом є цинковий електрод, а мідний – катодом. На аноди відбувається реакція окислення, сутність якої полягає в тому, що іони цинку переходять у розчин електроліту і взаємодіють із ним з утворенням солі: Zn + H2 SO4 = ZnSO4 + H2 , або в іонній формі Zn+2 ® Zn0 +2e
З виходом катіонів у розчин електроліту анод набуває негативного заряду за рахунок електронів, які залишились. Якщо електрони з аноду не видаляти, то через деякий час процес розчинення аноду припиниться, тому що накопичений негативний заряд зрівноважить сили, що сприяють виходу іонів у розчин. Якщо ж забезпечити перехід електронів з анода, то процес окислення буде відбуватися до повного розчинення анода.
На катоді відбувається реакція відновлення іонів міді: Cu+2 + 2e® Cu0. Електрони, що переходять з цинкового електрода, з’єднуються з іонами міді, що дегідратують з розчину і утворюють атоми міді, які виділяються у вигляді металу на поверхні мідного електрода. Сумарне рівняння реакції, що відбувається при роботі гальванічного елемента, має такий вигляд: Zn0 + CuSO4 = ZnSO4 + Cu0
Матеріал катода в цих хімічних реакціях участі не бере і тому не руйнується. Отже, катод сприяє видаленню електродів з анода й руйнуванню останнього. Електрорушійна сила (ЕРС) гальванічного елемента дорівнює різниці потенціалів його електродів. Чим далі знаходяться метали один від одного в ряду стандартних електродних потенціалів, тим більша електрорушійна сила гальванічного елемента, який з них складається. Е= φ°К- φ°А, (5.3)
де φ°К та φ°А– електродні потенціали металів катода та анода відповідно. Для визначення ЕРС гальванічного елемента застосовують компенсаційний метод.
5.3 Опис лабораторної установки
Лабораторна установка призначена для вимірювання електрорушійної сили гальванічних елементів та визначення електродних потенціалів. Вона складається з вольтметра з високоомним входом типу В7-23, а також каломельного електрода, нормального елемента, напівелемента: мідного, цинкового, олов’яного, нікелевого, свинцевого, алюмінієвого, залізного та ємності для електроліту. При вимірюванні ЕРС нерідко виникає необхідність у допоміжному елементі з відомою і стійкою ЕРС. Для цього в основному застосовують так званий нормальний елемент (або елемент Вестона) (рис. 5.3). В ньому негативний електрод являє собою амальгаму кадмію, розміщену у розчині сульфату кадмію, що насичений відносно кристалогідрату CdSO4 * 8/3Н2О і постійно стикається з ним. Позитивний електрод являє собою пасту із ртуті і Hg2SO4, що розміщена у такому ж розчині, насиченому відносно CdSO4 * 8/3 Н2О. Під пастою розміщено невелику кількість ртуті. Позитивний електрод працює зворотно відносно іонів SO4-2. При роботі такого елемента відбувається реакція: Cd + Hg2SO4 + 8/3 Н2О = CdSO4* 8/3 Н2О + 2 Hg (5.9)
Рисунок 5.3 – Нормальний елемент Вестона
При короткочасних замиканнях, наприклад, при застосуванні елемента для компенсаційних цілей, він працює досить зворотно і стало завдяки тому, що обидва електроди знаходяться у насиченому розчині. При 20°С його ЕРС дорівнює 1,01830 В, при 25 °С – 1,01807 В. Для визначення потенціалів мідного та цинкового електродів складають гальванічний елемент з електрода, що досліджується, і стандартного (рис. 5.4).
Рисунок 5.4 – Схема кола для вимірювання електродного потенціалу: ліворуч – електрод, потенціал якого досліджується, праворуч – каломельний електрод.
Найчастіше застосовують стандартний каломельний електрод – ртуть з покриттям суспензії каломелі Hg2Cl2 у розчині KCl. Потенціал насиченого каломельного електрода відносно водневого дорівнює φ°калом. = + 0,246 В. Для вимірювання потенціалу цинкового електрода застосовують електричне коло:
¯Zn | ZnSO4|| KClнас. | Hg2Cl2| Hg+ ЕРС кола дорівнює різниці потенціалів каломельного та цинкового електродів, тому: φ° Zn = φ°калом – Е (5.4) Слід пам’ятати, що ЕРС може мати лише позитивні значення, а потенціал електродів – або позитивне, або негативне.
5.4 Порядок виконання роботи і методичні вказівки до її виконання
Підключити нормальний елемент до клем вольтметра і провести вимірювання. Підсумки вимірювань записати в робочий журнал. Підготувати поверхню мідного, цинкового, залізного, алюмінієвого, олов’яного електродів механічною обробкою наждачним папером з послідовним промиванням дистильованою водою. Підготовлені електроди занурити у власні електроліти, попередньо влиті до вимірних комірок. Скласти гальванічні пари з різних елементів. З’єднувальним ключем поміж елементами використовують насичений розчин КСІ. Потім треба підключити електроди до клем вольтметра та провести вимірювання. Повторити вимірювання для мідного та цинкового напівелементів при концентрації їх електролітів 1 н та 0,01 н.
5.5 Методичні вказівки з оформлення звіту
Звіт повинен мати теоретичні обґрунтування та розрахунки Результати заміру та розрахунки слід оформити у вигляді таблиці Таблиця 5.1 – Результати вимірювання електрорушійної сили гальванічних елементів
5.6. Контрольні запитання та завдання
1. Що називається стандартним електродним потенціалом? 2. Як залежить стандартний електродний потенціал від природи металу та активності іонів, до яких він обернений? 3. Що називається гальванічним елементом? 4. Що називається електрорушійною силою гальванічного елемента? 5. Наведіть рівняння Нернста та дайте його пояснення. 6. Що таке стандартна електрорушійна сила гальванічного елемента? 7. Який принцип дії нормального елемента Вестона? 8. Яка хімічна реакція має місце при його роботі? 9. Як побудований каломельний електрод? 10. Як залежить потенціал каломельного електрода від концентрації хлориду калію? 11. Поясніть будову водневого електрода.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 580; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.3.235 (0.008 с.) |


 lg
lg 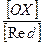 , (5.1)
, (5.1) lg [Me+n], (5.2)
lg [Me+n], (5.2)








