
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електрометричне Визначення рнСодержание книги
Поиск на нашем сайте
6.1 Мета роботи Виміряти рН ряду буферних розчинів за допомогою хінгідронного електрода та визначити константу дисоціації оцтової кислоти. 6.2 Методичні вказівки з організації самостійної роботи студентів Кислотність розчинів визначається активністю іонів водню, що утворився в результаті дисоціації оцтової кислоти. В наш час поширеним засобом визначення наявності іонів водню в розчині є водневий показник [1]. Останній являє собою десятковий логарифм активності іонів водню, взятий із оберненим знаком:
Чиста вода, хоча і в невеликою мірою, дисоціює на іони:
Застосовуючи закон діючих мас, одержимо:
де Внаслідок того, що ступінь дисоціації води малий, активність води практично можна вважати постійною та рівною її концентрації Тоді
Величина Згідно з рівнянням (6.2)
В розчині кислота дисоціює:
її константа дисоціації
Слабкі кислоти (оцтова та ін.) характеризують дуже малими значеннями констант дисоціації (
Логарифмуючи рівняння (6.5) та змінюючи знаки на обернені, одержимо:
Розглянемо властивості суміші слабкої кислоти, наприклад, оцтової, з її натрієвою сіллю. На відміну від оцтової кислоти, оцтовокислий натрій повною мірою дисоціює на іони. Тому активність іона Таким чином, при вимірюванні рН розчину можна розрахувати константу дисоціації кислоти – кількісну характеристику її кислотної властивості. Активність іонів водню, отже і рН, можна визначити за допомогою різних методів. З них найбільш опрацьованим та точним є електрометричний. Для електрометричного визначення рН необхідно зробити вимір потенціалу водневого електрода. Його потенціал має зв’язок з активністю водневих іонів:
За порівняльний треба взяти каломельний електрод. Слід зауважити, що застосування водневого електрода досить складне, тому його замінюють хінгідронним електродом. Останній являє собою платинову пластину, занурену у досліджуваний розчин, насичений хінгідроном. Хінгідрон – це еквімолекулярна сполука гідрохінону У водних розчинах він частково розпадається за рівнянням:
Гідрохінон – слабка кислота, яка незначною мірою дисоціює на іони:
Потенціал хінгідронного електрода
Нормальний електродний потенціал хінгідронного електрода при
Для приготування хінгідронного електрода в досліджуваний розчин всипають невелику кількість хінгідрону, щоб після насичення частина його залишилась в осаді. Для експериментального визначення рН складають гальванічне коло:
Електрорушійна сила такого кола
звідки
При 25
6.3 Порядок виконання роботи і методичні вказівки до її виконання
Необхідно провести вимір електрорушійної сили кола (6.11) компенсаційним методом на потенціометрі ППТВ-1. Під час роботи на потенціометрі слід дотримуватись такого порядку вимірів: 1. До відповідних клем потенціометра підключити батарею (звернути увагу на полярність), гальванометр, нормальний та досліджуваний елемент. 2. Провести компенсацію електрорушійною силою нормального елемента Вестона при положенні “НЕ” ручки перемикача. 3. Далі ручку перемикача перевести в положення “Х”, а потім, обертаючи ручки декад “2”, “3”, “4”, “5”, “6”, провести компенсацію електрорушійної сили досліджуваного об’єкту при послідовному підвищенні чутливості. Значення вимірюваної електрорушійної сили відраховують за цифрами у віконцях декадних реостатів. 4. При виконанні роботи гальванометр ввімкнути в ланцюг послідовним натисненням кнопок “50000 Ом” при грубій компенсації та “0” при більш точній. 5. При тривалій безперервній роботі потенціометра періодично перевіряти та регулювати його робочий струм, вмикаючи в ланцюг нормальний елемент. Для електрометричного визначення рН треба із початкових розчинів 0,2 н оцтової кислоти та ацетату натрію приготувати суміші у кількості 20 мл. Слід визначити рН кожного розчину та розрахувати рН оцтової кислоти за формулою (6.7). Результати роботи записують в табл. 6.1.
Т а б л и ц я 6.1 – Склад розчинів
Форма запису наведена у табл. 6.2
Т а б л и ц я 6.2 – Результати вимірювань та розрахунків рН
6.4 Контрольні запитання та завдання
1. Що називається рН? 2. Що являє собою водневий електрод? 3. Як залежить потенціал водневого електрода від активності водневих іонів? 4. Що являє собою хінгідронний електрод? 5. Яка рівновага встановлюється під час роботи хінгідронного електрода? 6. Які розчини мають назву буферних? 7. Що таке активність іонів та молекул? Коефіцієнт активності? 8. Що таке рК? Виведіть зв’язок поміж рК та рН. 9. Наведіть схему гальванічного кола для визначення рН розчину за допомогою водневого електрода. 10. Наведіть схему гальванічного кола для визначення рН розчину за допомогою хінгідронного електрода. 11. Виведіть зв’язок між рН та електрорушійною силою гальванічних кіл, складених: а) з водневого та каломельного електродів; б) хінгідронного та каломельного електродів.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 290; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.105.101 (0.009 с.) |

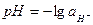 (6.1)
(6.1)


 , (6.2)
, (6.2) ,
,  ,
,  – відповідають активності
– відповідають активності  ,
,  , та
, та  , КВ – константа дисоціації води.
, КВ – константа дисоціації води. .
. . (6.3)
. (6.3)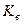 має назву іонний добуток води. Нейтральний розчин має рН =7, в кислих розчинах рН<7, в лугових рН>7, тобто для чистої води
має назву іонний добуток води. Нейтральний розчин має рН =7, в кислих розчинах рН<7, в лугових рН>7, тобто для чистої води  .
.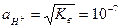 . (6.4)
. (6.4)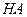
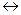
 ,
, . (6.5)
. (6.5) ). Такі константи прийнято виражати у вигляді показника констант, тобто у вигляді від’ємного логарифма констант дисоціації:
). Такі константи прийнято виражати у вигляді показника констант, тобто у вигляді від’ємного логарифма констант дисоціації: . (6.6)
. (6.6) . (6.7)
. (6.7)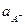 у рівнянні (6.7) практично повністю визначається коефіцієнтом активності
у рівнянні (6.7) практично повністю визначається коефіцієнтом активності  у розчині.
у розчині. *
*  . (6.8)
. (6.8) та хінону
та хінону  .
.
 .
.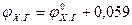
 . (6.9)
. (6.9) дорівнює 0,699 В та має досить великий температурний коефіцієнт:
дорівнює 0,699 В та має досить великий температурний коефіцієнт: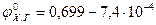 (
( ) (6.10)
) (6.10) . (6.11)
. (6.11)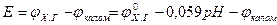 , (6.12)
, (6.12) (6.13)
(6.13)
 В,
В,  В.
В. /мл/
/мл/



