
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика предмета коллоидной химииСодержание книги
Поиск на нашем сайте
Введение Дисциплина, к изучению которой мы приступаем, до настоящего времени не получила общепринятого наименования, но при этом имеет точную дату своего возникновения – 1861г. Исторически первым было название - «коллоидная химия». Это было связано с тем, что в 1861г. английский химик Томас Грэм (1805-1869), один из основателей и первый президент Лондонского химического общества опубликовал работу, в которой сделал попытку классификации веществ по способности их растворов кристаллизоваться и диффундировать через полупроницаемые мембраны. Все вещества были им разделены на два класса: кристаллоиды (быстро диффундируют и способны к кристаллизации) и коллоиды (не диффундируют и не кристаллизуются). Согласно представлениям Грэма коллоиды, в отличие от кристаллоидов, не дают истинных растворов, имеют повышенную вязкость и неустойчивы во времени. К ним он отнес такие природные вещества как оксиды алюминия, железа, цинка, белки, танин, декстрины, крахмал, агар-агар, казеин и т.д. Большинство из приведенных веществ по своему физическому состоянию напоминают, либо используются для приготовления клеев, а клей по-гречески “ colla ”. Однако, уже в 1869 г. профессор Киевского университета Борщов сформулировал представления о коллоидах не как об особом классе веществ, а как о состоянии, присущем многим веществам в том числе и кристаллоидам. В последствие это положение было подтверждено многими работами и показано, что даже такие кристаллические вещества как поваренная соль и металлы могут быть переведены в коллоидное состояние. Таким образом термин “коллоид” означает особое состояние вещества, в котором могут находиться практически все известные тела. Это состояние характеризуется высокой степенью раздробленности (дисперсности) вещества, развитой удельной поверхностью с присущими ей многочисленными поверхностными явлениями. В связи с этим более современным наименованием дисциплины является не «Коллоидная химия», а «Поверхностные явления и дисперсные системы». Существуют и другие названия этому курсу: «Капиллярная химия», «Физическая химия реальных тел». Все они в той или иной степени отражают его содержание. Иногда словосочетание «Поверхностные явления и дисперсные системы» мы будем заменять «Коллоидная химия». Этой дисциплиной заканчивается изучение общехимических курсов и начинается изучение прикладных, т.к. изучаемые в ней законы и принципы сопровождают такие общехимические и технологические процессы: Измельчения Гранулирования Фильтрации Спекания Синтеза новых материалов Адсорбции Коррозии, склеивания, крашения, печатания Характеристика предмета коллоидной химии Количественные характеристики дисперсных систем
Для характеристики дисперсных систем используют три основных величины: Физический смысл – число частиц, расположенных на длине 1см или 1м
Рис.1 Зависимость удельной поверхности от поперечного размера частиц (d) и от дисперсности (Д)
В зависимости от размера частиц системы могут быть моно- и полидисперсные. Реальные системы - полидисперсные. Поверхностное натяжение Почему по водной поверхности бегают пауки? Почему металлическая игла удерживается на водной поверхности? Почему англичане еще в XVII – XVIII вв. выливали в бушующее море тюлений или китовый жир? Как норвежские рыбаки определяли место косяка сельди? Еще раз посмотрим на энергетическое положение атома внутри тела и на его поверхности.
Б.(на поверхности) Fрез≠0 и направлена внутрь тела
Втягивая поверхностные атомы внутрь, тело как бы стремится уменьшить свою поверхность. На поверхности возникает напряжение, вызванное наличием избыточной энергии из-за нескомпенсированности энергии поверхностных атомов. 1. Избыточная поверхностная энергия приходящаяся на единицу площади поверхности получила название поверхностного натяжения (σ) Физическая природа σ в нескомпенсированности поля межмолекулярных сил на межфазных поверхностях. 2. Его можно также трактовать как силу, действующую тангенциально поверхности (вдоль нее) и препятствующую увеличению поверхности. Опыт Дюпре с мыльной пеной. 3. σ – можно также рассматривать как работу, затраченную на разрыв межатомных или межмолекулярных связей, т.е. это работа образования единицы поверхности. На σ влияют T, q, добавки ПАВ. [σ]=Дж/м2; Нм/м2=Н/м. В СГС: дин/см; 1 Н/м=1000 дин/см Чем сильнее межмолекулярные связи в веществе, тем больше σ на его межфазной поверхности. Отсюда: H2O → σ=0,0721 Дж/м2
 C2H5OH → 0,0221 C2H5OH → 0,0221
Fe → 4,0 W → 6,8 Алмаз → 11,4 – макс. знач. Строение ДЭС Представление о строение ДЭС за сто лет истории претерпели изменения Квинки сделал предположения об его образовании. Гельмгольц и Перрен представляли его строение по аналогии со строением плоского конденсатора. Предполагалось, что на границе прикасающихся фаз заряды располагаются в виде двух рядов разноимённых ионов. Толщина слоя считалась близкой к размерам молекул или сольватированных ионов на этом расстоянии φ уменьшалась до 0. Поверхностный заряд определяется в соответствии с теорией плоского конденсатора. Гюи (Франц) Однако, такое строение возможно без учёта теплового движения ионов. Независимо друг от друга Гюи и Чепмен предположили строение ДЭС с учётом теплового движения. По их мнению все противоионы будут рядом с потенцио определяющим ионами только при 279 К. При более высоких температурах из-за кинетической энергии ионов они располагаются не упорядочено, образуя размытую диффузную структуру Отто Штерн (нем). – нобелевская премия.
Современная теория строения ДЭС предложена Штерном. Она объединяет обе предыдущие теории: слой противоионов состоит из двух частей: в близи поверхности есть адсорбционный слой Гельмгольца, Толщиной δ не более диаметра гидратированных ионов; далее находится диффузный слой Гюи, толщиной λ с потенциалом φδ, зависящих от свойств и состава системы. Т.к. противоионы в диффузной части распределены неравномерно, φ его изменяется не линейно qДЭС = qδ + qλ, где qδ и qλ – заряды на межфазной поверхности и границе слоя Гельмгольца. В свою очередь: qδ= qэлектростатич.вз.+ qковалент.св. из-за наличия различных адсорбционных центров. Гуи и Чепмен предположили, что в диффузной части ионы в результате теплового движения распределяются в соответствии с законом Больцмана. В результате было в ведено уравнение, определяющее связь ДЭС с расстояние от поверхности (уравнение Гуи-Чепмена). При φд.э.с.<<25мВ φх=φδе-х/λ, при х=λ, φх=φδ/е, т.е. за толщину дифференциальной части д.э.с. берется расстояние на котором φ уменьшается в «е» раз (2,718 раз). Каково же это расстояние? Так симметрично одновалентного элемента при его концентрациях 10-1, 10-3, 10-5 моль/л, λ=1,10,100 нм, т.е. Полная электрическая емкость д.э.с. выражается как суммарная емкость двух последовательно соединенных конденсаторов В разбавленных растворах сδ>>cλ, отсюда с@сλ, т.к. δ<<λ. Примеры д.э.с. и строение мицеллы Система AgJ – вода (избыток AgNO3)
систем AgJ-вода (избыток KJ)
Для амфотерных веществ заряд поверхности может изменяться в зависимости от pH среды. В этом случае потенциалопределяющими ионами могут быть либо OH-, либо H+. 4.3 Термодинамика образования д.э.с. Уравнение Габриэль-Липмана Образование д.э.с. происходит самопроизвольно в результате стремления системы уменьшить энергию поверхностного слоя. Избыточная поверхностная энергия при образовании д.э.с. превращается в электрическую. Из объединенного уравнения I и II начал т.д. имеем:
Полный дифференциал энергии Гиббса
вычитая из него первое уравнение имеем
Оно определяет связи между q, φ, σ д.э.с. Если знаки qs и φ совпадают, то с увеличением φ σ уменьшается
Если знаки qs и φ различны, то с увеличением φ σ увеличивается. При малом значении qs σ слабо зависит от φ. В реальных системах, стремящихся к равновесию, знаки qs и φ совпадают, а значит уменьшение σ сопровождается увеличением φ. Емкость конденсатора
Оно позволяет определить с, зная зависимость σ от φ. 4.4 Уравнение электрокапиллярной кривой. Название связано с прибором капиллярным электрометром, используемым Липманом для экспериментов по выводу этого уравнения. Емкость
Если принять φ=0 в точке «0» заряда Симметричность ветвей параболы говорит о равном сродстве катионов и анионов к поверхности, если они выступают в качестве противоионов. Обычно ветви несимметричны. Вершина кривой отмечает точки «О» заряда в этой точке: Для оксидов и гидроксидов, у которых в воде потенциал определяющими ионами являются OH- и H+. Точка «О» заряда соответствует определенному значению pH (здесь величины зарядов обоих знаков равны, их алгебраическая сумма равна нулю). pHи.э.т. зависит от кислотно-основных свойств вещества.
Чем больше кислотность вещества, тем меньше pHи.э.т. Типы адсорбции Согласно физико-химической классификации различают: 1) Физическая адсорбция (молекулярная) 2) Хемосорбция (химическое присоединение атомов и молекул) 3) Ионный обмен Физическая адсорбция реализуется сил Ван-дер-Вальса. Они включают силы Франца, Лондона, создают дисперсионный эффект. За счет флуктуаций эмбрион плотностей соседних атомов – 65-70% вклад. - силы Кеезома, создают ориентационный эффект при деполь-депольном взаимодействии полярных молекул – 25-30% - силы Дебая, создают индукционный эффект за счет индуцирования деполя в неполярной молекуле при взаимодействии ее с полярной – 5% Для всех 3х составляющих выполняется закон изменения энергии от расстояния.
с – const, своя для каждого эффекта; m ≈ 12. Полная потенциальная энергия взаимодействия двух атомов:
При адсорбции идет взаимодействие адсорбируемого атома со многими атомами вещества. С учетом способности адс. взаимодействий к аддитивности после математических операций получим:
Вывод: 2. Чем больше атомов в молекуле, тем лучше адсорбция, т.к.
Хемосорбция – обусловлена силами химической природы (ионное взаимодействие, образование ковалентных, водородных связей). При этом может теряться индивидуальность исходных компонентов.
Четкой границы между физической адсорбцией и хемосорбцией нет. Физическая адсорбция может предшествовать хемосорбции. Один и тот же Адсорбат может адсорбироваться по различному механизму в зависимости от условий. Адсорбция О2 на угле.
Десорбция уже СО или СО2
Отличия физической адсорбции от хемосорбции не вникая в механизм взаимодействия: ü величина ü универсальность и слабая специфичность физической адсорбции по сравнению с хемосорбцией ü обратимость физической адсорбции ü характер температурной зависимости Ионный обмен Эквивалентный обмен ионов адсорбата на ионы того же знака адсорбента называется ионным обменом. Проявляется в гетерогенной системе т-ж, ж-ж, когда из жидкой фазы могут не переходить ионы в твёрдую фазу или другую не смешивающую жидкость. Суть ионного обмена в эквивалентном обмене. Адсорбенты способные к такому обмену называются ионообменниками или ионитами. Они находят большое применение. Их классифицируют: - на природные (торф, почвы гидроокиси металлов) и синтетические (ионообменные смолы, цеолиты, феррцианиты и тд.) - по составу: на органические (ионообменные смолы и тд.) и неорганические (сульфиды силикаты) - по знаку заряда обменных ионов на катиониты (КУ-2), аниониты (АВ-17, АН-31), амфолиты (АНКБ-34), гидроокиси металлов (ЭДЭ-10П) Механизм адсорбции на катионите может быть. R-COO-H + Na+ → R-COONa + H+ Адсорбция идёт на функциональных группах. Используется в металлургии, извлечении ценных компонентов, очистки воды, крови и тд. Особенности ионного обмена 1. Эквивалентность обмена 2. Адсорбция заряженных частиц (ионы, радикалы) 3. Неуниверсальный характер 4. Наличие рядов селективности Лиотропный ряд Na+<K+<Rb+<Cs+ Электроселективный ряд Fe3+>Ca2+>Na+ Ёмкость ионита по адсорбционным ионам определяется как COE или DOE, выражается мг-экв/г, мг-экв/см3, или мг/г, мг/см3. COE до 10-12мг-экв/г. Важные характеристики: 1. ёмкость 2. селективность 4. способность к регенерации Метод разделения основан на различие в адсорбции веществ некоторыми адсорбентами называется хроматографией. Адсорбция на границе ж-г При растворении вещества в жидкости возможно 1. растворённое вещество не меняет σ-сахар 2. растворённое вещество увеличивает σ –неорганические электролиты 3. растворённое вещество уменьшает σ – органические вещества Вещества, которые увеличивают σ называются инактивными Вещества, которые уменьшают σ называются ПАВ В адсорбционном уравнении Гиббса для растворенных веществ
Влияние природы вещества на адсорбцию отражает dσ/dc. Она определяет знак Г. Величина Физический смысл – это сила удерживающая вещество на поверхности и рассчитанная на единицу Гиббсовской адсорбции. Единица измерения: Н*м2/моль; Дж*м/моль. g=-tgα касательной к кривой σ = f(с) в точке пересечения её с осью ординат Если g>0 g<0 Толщина насыщенного адсорбционного слоя Обычно h совпадает с длинной правильно ориентированной в ней молекулы адсорбированного вещества. Насыщенный адсорбционный слой представляет собой сплошной “молекулярный ковёр” адсорбционного вещества. Уравнение Шишковского Большинство органических веществ являются ПАВ. Все они имеют дифильное строение: 1. по типу гидрофильных групп различают ионогенные и неионогенные ПАВ (жирные кислоты) ионогенные: - анионные карбоновые кислоты и их соли, стеарат Na: C17H35COONa, олеат Na: C17H33COONa - катионные соли алифатических и ароматических аминов - амфолитные (в зависимости от pH проявляют катионные или анионные, активные свойства, т.е. имеют –COOH или –NH2 группы) Поверхностная активность зависит от длины углеводородной цепи. Согласно правилу Дюкло-Трауба в гомологическом ряду жирных кислот при удлинение углеводородной цепи на 1 CH2 группу увеличивается g в 3-3,5 раза (3,2раз) Поверхностная активность вещества характеризуется также величиной ГЛБ (гидрофильно-липофильного баланса) – соотношение моль массы гидрофильной и гидрофобной групп. Согласно эмпирическим циклам Гриффита ГЛБ изменяется от 1 до 40, ТЭА – 12; олеат Na – 18, олеиновые кислоты 1 Переход ПАВ из истинно растворимого состояния в коллоидное характеризуется ККМ (критическая концентрация мицеллообразования). Это минимальная концентрация ПАВ, которая характеризует образование концентрированного раствора. Солюбилизация – включение внутрь мицеллы частиц. Поверхностная активность олеата Na (мыла) составляет ~ 4*107 Гиббс, т.е. на межфазной поверхности его концентрация не будет в 30 тыс.раз больше, чем в объёме, а значит концентрацией ПАВ в объеме можно пренебречь. Шишковским было введено эмпирическое уравнение, характеризующее изменение σ от концентрации ПАВ в растворе.
А, В – опытные константы В – константа для всего гомологического ряда А – константа изменения в соответствии с правилом Траубе. Потом это уравнение было выведено теоретически из предположения А=Г и обосновано физическим смыслом обеих констант. Комбинируя уравнение Гиббса с уравнением Шишковского для растворов жирных кислот
А – константа адсорбционного равновесия. Способность твердых адсорбентов поглощать газы и пары определяется состоянием и однородностью его поверхности и степенью пористости. Активность различных участков поверхности неоднородна. Так первые порции О2 на угле адсорбируются с
Получение пористых тел: 1) гидрозоль → коагуляция → сушка геля → дробления (d=0,1-7нм) так получают SiO2, Al2O3, MgO, цеолиты (0,4-1,1нм) 2) высокотемпературная активизация угля – сырца (торфа, костей) Т=700-900 ºС в атмосфере водяного пара, CO2 некоторых кислот (HCl, HNO3 и др) 3) Ni-гидрат выщелачивает Ni-Al сплавы. 5.5 Закон Генри (англ. уч. Уильям Генри 1836) Общим термодинамическим уравнением адсорбции является адсорбционное уравнение Гиббса, связывающее σ и μ.
Однако, рассмотрение адсорбции как процесса взаимодействия адсорбата с адсорбентом требует учета различных механизмов. Наиболее просто этот вопрос решается для систем «г-ж» и «ж-ж» в связи с энергетической однородностью поверхности жидкости. В этом случае активности отдельных участков адсорбционного поля практически выравниваются. Для твердых тел присутствует сильная неоднородность как геометрическая, так и эмпирическая. Пусть адсорбционный слой рассматривается как отдельная фаза:
Для объема
Эти уравнения выражают изотерму адсорбции в общем виде. Если с→0, то
Здесь КГ – const Генри При разбавлении системы адсорбция пропорциональна концентрации с коэффициентом пропорциональности КГ При разбавлении системы коэффициент распределения стремится к константе (КГ). Для газов С определенной концентрацией «со» начинается отклонение от закона Генри. Величина и знак отклонений определяется соотношением сил взаимодействия адсорбционных частиц между собой и с поверхностным слоем. Если взаимодействие частиц адсорбата с поверхностным слоем больше, чем между собой, то А возрастает и Д возрастает → «1» Изотерма адсорбции Ленгмюра (ам. уч. Ирвинг Ленгмюр, Нобел. Прем.) Фундаментальным вкладом в учение об адсорбции является изотерма Ленгмюра. Она позволяет учесть отклонения от закона Генри, связанные с ограниченной поверхности адсорбента. Вывод уравнения Ленгмюра базируется на трех постулатах: 1. Адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с 1 молекулой адсорбата, образуя мономолекулярный слой. 2. Адсорбционные центры энергетически эквипотенциальны, а поверхность эквипотенциальна. 3. Адсорбируемые молекулы не взаимодействуют друг с другом. Рассмотрим адсорбцию как квазихимическую реакцию
Для газов: К и КР характеризуют энергию взаимодействия адсорбата с адсорбентом (чем больше К, тем сильнее взаимодействие).
При С→0 Т.е. уравнение Ленгмюра является более общим соотношением, включающим в себя уравнение Генри. При больших С или Р КС>>1; Это отвечает насыщению адсорбата. Отсюда
Уравнение Ленгмюра очень часто решается Графически. Для этого оно приводится к линейной форме
Электрокинетические явления 1809 Рейс (московский профессор), Фердинанд Фридрих (немец). Явление перемещения жидкости в пористых телах под действием электрического поля называется электроосмосом. Явление перемещение частиц дисперсной фазы в электрическом поле называется электрофорезом (частицы имеют заряд противоположный жидкости)
1859г. Квинке показал, что серц. Явление обратное электроосмосу, т.е. при течение жидкости через пористое тело под давлением возникает разность потенциалов. Явление называется потенциалотечение или протекание. Наблюдается при продавливании жидкости через дерево, глину, песок, графит и тд.
1887г. Дорн измерил
Таким образом электрокинетические явления по причинно следственным признакам делят на 2 группы: 1. электроосмос, электрофорез – движение фаз вызывается 2. потенциалотечение и потенциалоседиментации – движение фаз вызывают Причина электрокинетических явлений в наличии на границе фаз ДЭС. При движении фаз происходит разрыв ДЭС по плоскости скольжения, которая проходит через диффузный слой. В результате дисперсная среда и фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения, называется ξ – потенциалом или электрокинетическим потенциалом. ξ всегда меньше потенциала диффузного слоя. Величина ξ зависит от природы фаз, Т, ε, Z, η и может составлять 100 мВ и больше (оксиды). Электроосмос Линейная скорость:
L – расстояние между электродами
I – сила тока, R – сопротивление
это приращение проводимости в растворе за счет ДЭС, если диаметры капилляров велики Электрофорез Подвижность:
В разбавленных растворах при 20 ºС:
с – концентрация суспензии; S – поверхность электродов. Уравнение Гельмгольца-Смоулховского для ξ – потенциала через потенциал течения имеет вид:
Е – напряжение поля, возникающее при седиментации.
Потенциал течения и потенциалседиментации могут являться причиной взрывов и пожаров при перекачке топлива, технологических растворов, осаждении суспензий и эмульсий в связи с возникновением высоких
Практическое использование: электроосмос – осушка различных объектов (стен зданий, сыпучих материалов, при строительстве плотин, дамб), электроды – полые трубы с отверстиями → откачка, фильтрация – трудно фильтруемых сред электрофорез – в авто и электронной промышленности нанесение покрытий равномерно на детали сложной формы. 1й электрод – деталь, 2й электрод – емкость с суспензией. Анодофарез и катодофарез – деталь. Медицина – фракционирование полимеров. Смачивание. Краевой угол Часто предшествует адгезии явление взаимодействия «ж» с «т» или другим «ж» при наличии одновременного контакта 3х несмешивающихся фаз (одна обычно газ). Отличие от адгезии: степень смачивания характеризуется краевым углом либо косинусом угла смачивания. Под ним понимают угол, образованный касательной к межфазной поверхности с вершиной на линии раздела фаз. Капля жидкости на твердой поверхности либо растекается либо принимает определенную форму. 1) Наличие избыточной поверхностной энергии твердого тела растягивает каплю - 2) Когезионные силы - 3) Сниженная поверхностная энергия межфазной поверхности
В равновесии:
Чем больше При
Т.к. Для минералов: кварц - малахит - 17º графит - 55º парафин - 106º тефлон - 108º Разные жидкости неодинаково смачивают одну и ту же поверхность.Ө - измеряют по проекции межфазной поверхности на экране (чистота поверхности). Эффект Марагони. сичка + мыльная вода Течение жидкости в поверхностных слоях, вызвано градиентом σ. Движение жидкости от малых σ в сторону больших σ. Интенсифицируют: добавки ПАВ, градиент Т, концентрация. Большая роль в процессах массопереноса (экстракция, адсорбция, конвекция и т.д.). Эффект Марангони влияет на устойчивость пленок. Капля спирта на пленку Н2О вызывает сухое место (вода разбегается). Правило Антонова Если две жидкости находятся в контакте друг с другом, то со временем они взаимно насыщаются и в связи с этим снижается растекание из-за умнеьшения разницы поверхностных натяжений этих веществ на границе с воздухом.
Так в системе бензол – вода Антонов на основе большого количества экспериментов, где Межфазное натяжение между двумя взаимно насыщенными жидкостями равно разности поверхностных натяжений их взаимно насыщенных растворов на границе с воздухом:
Флотация (флот – плавать на поверхности воды) Технологический процесс разделения мелких твердых частиц различных веществ, а также капель дисперсной фазы, основанный на их различной смачиваемости. Может быть пенная, масляная, ионная и т.д. обогащение руд, очистка сточных вод. Процесс ведут во флотационных машинах (механические, пневматические, комбинированные). Суть процесса – через суспензию мелкоразрубленные руды (сульфидной) в воде бомбардируют воздухом в виде мелких пузырей, к которым прилипают плохо смачиваемые частицы (сульфидов), а хорошо смачиваемые частицы (силикатные породы) остаются в растворе. Затем вынесенные частицы сгребают с поверхности. Для увеличения эффективности процесса в раствор добавляют: 1.ПАВ – для увеличения пенообразования 2.собиратели – гидрофобизирующие поверхность сульфидов 3.регуляторы – гидрофилизирующие поверхность породы Седиментационный анализ. (исследование дисперсных систем в гравитационном или центобежном поле). Цель – определение гранулометрического состава дисперсной фазы, распределение частиц по размерам, а также определение Sуд., преобладающего размера. Методы, которые в основе: - измерение скорости осаждения - измерение распределения частиц по высоте 1 – метод для r 10-4 – 10-7 м 2 – метод для r < 10-7м с использованием центробежного поля (для крупных молекул) I метод.
Если - Частицы имеют сферическую форму - Движутся ламинарно с U – const
|
||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 302; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.169 (0.012 с.) |

 ; [SVуд]=см2/см3=см-1(м-1)
; [SVуд]=см2/см3=см-1(м-1)
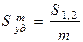 ;[Smуд]=см2/г, м2/кг
;[Smуд]=см2/г, м2/кг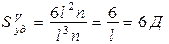


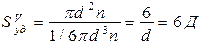
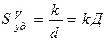 , где k – коэффициент формы
, где k – коэффициент формы
 А.(внутри)
А.(внутри) Fрез=0
Fрез=0

 , т.е. много больше диаметра ионов.
, т.е. много больше диаметра ионов. ,
,
 - мицелла
- мицелла
 , при T, p, ni – const
, при T, p, ni – const
 или
или  - 1 уравнение Липмана.
- 1 уравнение Липмана.
 . Считая д.э.с. конденсатором и подставив в это уравнение значение q из 1 уравнения Липмана
. Считая д.э.с. конденсатором и подставив в это уравнение значение q из 1 уравнения Липмана - 2 уравнение Липмана.
- 2 уравнение Липмана. подставив в 1 уравнение Липмана д.э.с.
подставив в 1 уравнение Липмана д.э.с. ;
;  ;
;  . Проинтегрируем по σ от σ до σmax и по φ от φ до φ0 (точка нулевого заряда) получим:
. Проинтегрируем по σ от σ до σmax и по φ от φ до φ0 (точка нулевого заряда) получим:

 - уравнение капиллярной кривой. Оно характеризует изменение σ от φ при с=const.
- уравнение капиллярной кривой. Оно характеризует изменение σ от φ при с=const. , т.е. σ не зависит от φ, но φ может быть ≠0, его тогда называют потенциалом «нулевого заряда».
, т.е. σ не зависит от φ, но φ может быть ≠0, его тогда называют потенциалом «нулевого заряда». .
. ,
,  ;
;
 , т.к. получили вместо 6 степени 3 можно сказать, что адсорбционные силы имеют более дальнодействующий характер:
, т.к. получили вместо 6 степени 3 можно сказать, что адсорбционные силы имеют более дальнодействующий характер: , n – число атомов, с которыми идет взаимодействие.
, n – число атомов, с которыми идет взаимодействие. .
. выше в несколько раз.
выше в несколько раз.

 - физическая адсорбция.
- физическая адсорбция.
 - хемосорбция
- хемосорбция
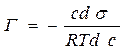
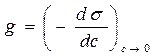 называется поверхностной активностью адсорбата (Ребиндер)
называется поверхностной активностью адсорбата (Ребиндер)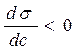 ,
, 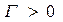
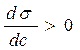 ,
, 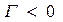 концентрация в объёме большая.
концентрация в объёме большая.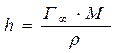
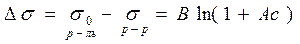
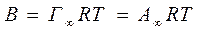
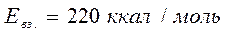 .
.

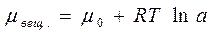
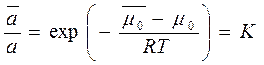 , где К – const, не зависящая от «с»
, где К – const, не зависящая от «с»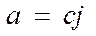 ;
; 
 ;
; 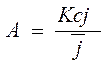
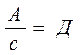 - коэф. распределения.
- коэф. распределения. 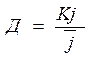
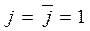
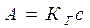 ;
;  - закон Генри
- закон Генри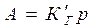
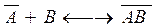
 - адсорбционный центр
- адсорбционный центр - Адсорбционный комплекс
- Адсорбционный комплекс ;
;  - величина адсорбции
- величина адсорбции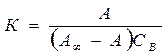 ;
;  - число адсорбционных центров
- число адсорбционных центров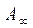 -емкость адсорбционного монослоя, число адсорбционных центров на ед. площади поверхности или массы
-емкость адсорбционного монослоя, число адсорбционных центров на ед. площади поверхности или массы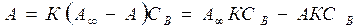
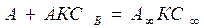
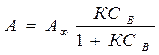 - уравнение изотермы Ленгмюра
- уравнение изотермы Ленгмюра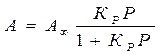
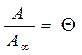 - степень заполнения поверхности адсорбента
- степень заполнения поверхности адсорбента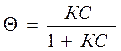
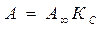 ;
; 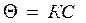 - изотерм Генри
- изотерм Генри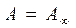 и
и 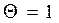
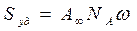
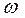 - площадь, занимаемая одной молекулой
- площадь, занимаемая одной молекулой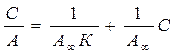
 ~
~  .
. при седиментации частиц кварца в центробежном поле, т.е. открыл явление обратное электрофорезу – возникновение
при седиментации частиц кварца в центробежном поле, т.е. открыл явление обратное электрофорезу – возникновение 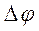 при осаждении дисперсной фазы получила название потенциалоседиментации или осаждения (эффект Дорна).
при осаждении дисперсной фазы получила название потенциалоседиментации или осаждения (эффект Дорна).

 - уравнение Гельмгольца-Смоулховского.
- уравнение Гельмгольца-Смоулховского.
 - электроосмотическая подвижность [м2/сВ]
- электроосмотическая подвижность [м2/сВ]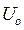 через объемную скорость можно выразить как
через объемную скорость можно выразить как  , где S – поперечное сечение в капилляре.
, где S – поперечное сечение в капилляре.
 ;
;  ;
; ;
; 
 - Δφ
- Δφ - удельная объемная электропроводность
- удельная объемная электропроводность - поверхностная проводимость
- поверхностная проводимость - коэф. эффективности диафрагмы
- коэф. эффективности диафрагмы
 ;
; ;
; ;
;
 - число частиц в единице объема;
- число частиц в единице объема;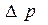 заменится на
заменится на  .
. .
. . Этому препятствует:
. Этому препятствует: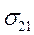
 .
.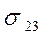 - пытаются сжать каплю.
- пытаются сжать каплю.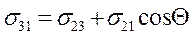 - закон Юнга.
- закон Юнга.
 (меньше
(меньше  ), тем лучше смачивание поверхности.
), тем лучше смачивание поверхности.
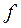 уменьшается с 8,8 до -1,6, т.е. через какое-то время скатывается в капли.
уменьшается с 8,8 до -1,6, т.е. через какое-то время скатывается в капли. , сформировал правило:
, сформировал правило:
 или
или 



