
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция на поверхности раздела жидкость – газСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для интерпретаций явлений адсорбции на границе раствор — газ весьма существенно установить связь между избытком адсорбированного вещества в поверхностном слое Г, концентрацией поверхностно-активного вещества в растворе с и поверхностным натяжением а на границе раствор — газ. Эта связь для разбавленных растворов дается известным уравнением адсорбции Гиббса, выведенным им в 1876 г.:
Уравнение адсорбции Гиббса устанавливает взаимосвязь адсорбции с концентрацией вещества в растворе и его поверхностной активностью. Поверхностная активность вещества, а значит, и адсорбция зависит от ряда факторов. 1. Природы вещества: ПАВ будут накапливаться в поверхностном слое (положительная адсорбция); поверхностно-инактивные вещества, наоборот, удаляться из поверхностного слоя (отрицательная адсорбция), если вещество не влияет на поверхностное натяжение, то адсорбции не наблюдается. 2. Полярности молекулы: уменьшение полярности молекулы приводит к росту поверхностной активности, а следовательно, к увеличению адсорбции.
3. Строения молекулы: для членов одного гомологического ряда увеличение длины углеводородного радикала на одно звено (−СН2−) приводит к увеличению поверхностной активности водных растворов этих веществ в 3 – 3,5 раза, при этом величина предельной адсорбции остается постоянной (эмпирическое правило Дюкло-Траубе). Математически правило Дюкло-Траубе может быть записано в виде следующего уравнения:
Правило Дюкло-Траубе объясняется определенной ориентацией молекул ПАВ в поверхностном слое (И. Ленгмюр, 1915 г.). При адсорбции полярная группа втягивается в полярный растворитель, например, в воду, а неполярный радикал выталкивается в неполярную фазу, например, в воздух (см. рис. 12). Происходящее при этом уменьшение поверхностной энергии ограничивает толщину поверхностного слоя размером с молекулу адсорбтива. Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция Г∞ не зависит от длины углеводородного радикала, а определяется только размерами поперечного сечения молекулы, которые в данном гомологическом ряду не меняются.
Пользуясь уравнением Гиббса, по изотерме поверхностного натяжения для поверхностно-активного вещества легко построить соответствующую изотерму адсорбции следующим образом. Возьмем какую-нибудь точку на изотерме поверхностного натяжения и проведем через нее касательную и прямые, параллельные осям координат, как это показано на рис. 13. Отрезок, отсекаемый на оси ординат касательной и прямой, параллельной оси концентраций, деленный на отрезок абсциссы, отсекаемый на ней прямой, проведенной через точку параллельно оси ординат, равен − C (dσ/d C), т. е.
Подставив значение, найденное для −dσ/d C, в уравнение Гиббса, получим:
Определив для ряда точек изотермы поверхностного натяжения соответствующие значения величины Г, легко построить изотерму адсорбции. Кроме того, для нахождения производной ds/d C можно воспользоваться эмпирическим уравнением Б.А. Шишковского, полученным им в 1908 г.
где σ0 и σi – поверхностное натяжение чистого растворителя и раствора соответственно; a и b – эмпирические константы. Уравнение Шишковского хорошо применимо для вычисления поверхностного натяжения жирных кислот с не слишком большим числом атомов углерода в молекуле (до С8). Из уравнения Шишковского следует, что
После подстановки в уравнение изотермы адсорбции Гиббса получим:
Теоретическое обоснование эмпирическое уравнение Б.А. Шишковского получило в рамках теории мономолекулярной адсорбции И. Ленгмюра (1917 г.), основные положения которой приведены ниже. =При адсорбции образуется насыщенный мономолекулярный слой адсорбированного вещества. =Адсорбция является квазихимическим процессом взаимодействия между адсорбатом и адсорбентом, который можно описать с помощью величин, характеризующих химическую реакцию (тепловой эффект, энергия Гиббса, константа скорости процесса и т. п.), но при этом превращение веществ отсутствует. =При адсорбции молекулы не могут перемещаться по поверхности, т.е. она локализована. =Адсорбированные молекулы не взаимодействуют друг с другом. Уравнение адсорбции Ленгмюра имеет вид:
Тогда константа а уравнения Шишковского связана с величиной предельной адсорбции: а = Г∞ RT; постоянная b имеет физический смысл константы равновесия процесса адсорбции. По величине Г∞ можно рассчитать размеры молекул ПАВ: площадь поперечного сечения где NA – число Авогадро; длину молекулы где М ПАВ – молярная масса ПАВ, d ПАВ – плотность раствора ПАВ.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.191.241 (0.006 с.) |

 для разбавленных растворов
для разбавленных растворов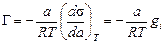 для концентрированных растворов.
для концентрированных растворов.
 .
.
 .
. .
. ,
, .
. .
.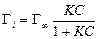 .
. ,
, ,
,


