
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа №11. Определение чисел переноса ионовСодержание книги
Поиск на нашем сайте
Цель работы: определить числа переноса катиона и аниона заданного раствора электролита. Сущность метода. Метод определения чисел переноса по Гитторфу основан на измерении концентрации электролита в приэлектродных пространствах до и после электролиза с пересчетом на изменение количества вещества (Δn) катиона и аниона. Схема лабораторной установки показана на рис. ____. При электролиза серной кислоты происходит разложение воды. На катоде – восстановление водорода Оборудование и реактивы. Источник постоянного тока; реостат; амперметр; штатив с лапами – 2 шт.; графитовые электроды – 2 шт.; свинцовые электроды – 2 шт.; стакан химический объемом 100 мл – 2 шт.; стакан химический объемом 500 мл – 1 шт.; стакан химический объемом 50 мл – 1 шт.; бюретка с краном объемом 25 мл – 2 шт.; бюретка с шариком объемом 25 мл – 1 шт.; мерная пипетка (Мора) объемом 20 мл – 1 шт.; мерная пипетка объемом 50 мл – 1 шт.; мостик электролитический с краном – 1 шт.; колба коническая объемом 250 мл – 2 шт.; мерный цилиндр объемом 50 мл – 1 шт. наждачная бумага; серная кислота – 1 н. раствор; серная кислота – 0,02 н. раствор; груша; гидроксид натрия – 0,02 н. раствор; фенолфталеин. Выполнение работы 1. В химические стаканы объемом 50 мл мерной пипеткой отобрать по 50 мл 0,02 н. раствора серной кислоты. 2. В стаканы поместить электролитический ключ. 3. Открыть кран ключа и при помощи груши заполнить его 0,02 н. раствором серной кислоты, после чего закрыть кран ключа. 4. Свинцовые электроды зачистить наждачной бумагой и поместить их в химические стаканы объемом 50 мл с 0,02 н. раствором серной кислоты.
5. В химический стакан объемом 500 мл налить около 450 мл 1 н. раствора серной кислоты. 6. В химический стакан объемом 500 мл с серной кислотой опустить две бюретки с краном и графитовые электроды так, как показано на рис. 8. При помощи груши заполнить бюретки 1 н. раствором серной кислоты до середины бюретки и отметить уровень жидкости в каждой бюретке. Краны бюреток закрыть. 7. Оформить установку в соответствии с рис. 8. 8. Включить ток при максимальном сопротивлении реостата. 9. Установить значение силы тока 7 - 10 А. 10. Вести электролиз в течение часа. 11. Выключить ток. 12. Открыть кран электролитического мостика. 13. При помощи мерного цилиндра измерить объем жидкости в катодном и анодном пространстве (стакан объемом 50 мл № 1). 14. Из катодного пространства мерной пипеткой объемом 20 мл в две конические колбы объемом 250 мл отобрать 2 пробы. 15. К пробам добавить по 4 капли фенолфталеина. 16. Оттитровать пробы 0,02 н. раствором гидроксида натрия. 17. Из анодного пространства мерной пипеткой объемом 20 мл в две конические колбы объемом 250 мл отобрать 2 пробы. 18. К пробам добавить по 4 капли фенолфталеина. 19. Оттитровать пробы 0,02 н. раствором гидроксида натрия. Содержание протокола лабораторной работы Электролит _______________. Исходная концентрация электролита C 0 = ______ н. Температура Т = ________°С. Атмосферное давление Р атм = _________ мм рт. ст. Объем 1 н. раствора серной кислоты в бюретках до начала электролиза V 1 = ________ мл; V 2 = ________ мл; Сила тока __________ А Продолжительность электролиза _____ мин. Уровень 1 н. раствора серной кислоты в бюретках по окончании электролиза V *1 = ________ мл; V *2 = ________ мл; h 1 = ________ мм; h 2 = ________ мм Концентрация титранта (гидроксида натрия) CT = ________ н. Объем раствора в катодном пространстве VK = __________ мл Объем пробы, взятой для анализа Va,K = ______ мл Объем титранта
Средний объем титранта Объем раствора в анодном пространстве VА = __________ мл Объем пробы, взятой для анализа Va,A = ______ мл Объем титранта
Средний объем титранта
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 678; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.57.239 (0.006 с.) |

 ; на аноде – окисление кислорода:
; на аноде – окисление кислорода:  . При этом сульфат-ионы перемещаются к аноду, катионы водорода – к катоду. У анода концентрация серной кислоты увеличивается, у катода – уменьшается. Уменьшение концентрации кислоты в катодном пространстве равно ее увеличению в анодном.
. При этом сульфат-ионы перемещаются к аноду, катионы водорода – к катоду. У анода концентрация серной кислоты увеличивается, у катода – уменьшается. Уменьшение концентрации кислоты в катодном пространстве равно ее увеличению в анодном.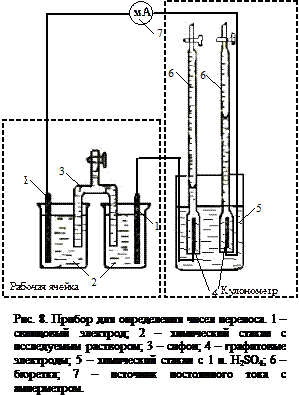
 = ________ мл
= ________ мл = ________ мл.
= ________ мл.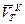 = ______ мл
= ______ мл = ________ мл
= ________ мл = ________ мл.
= ________ мл. = ______ мл
= ______ мл


