Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ содержания кобальта и никеляСодержание книги
Поиск на нашем сайте
Отобрать мерной пипеткой в две конические колбы аликвоты объемом 10 мл. Прилить в каждую колбу по 10 мл хлорида аммония (с помощью мерного цилиндра) и дистиллированную воду до объема 40-50 мл. Добавить немного сухого индикатора «мурексид». Титровать раствором трилона Б до переход окраски индикатора в эквивалентной точке от желтой к фиолетовой. Примечание: желтую окраску раствора в ходе титрования поддерживают добавлением NH4OH, т.е., если в ходе титрования раствор краснеет, то следует добавить несколько капель аммиака и он снова станет желтым. 10. Результаты эксперимента (рН и результаты титрования) занести в таблицу. Содержание протокола лабораторной работы Название экстрагента: Концентрация экстрагента: Растворитель: Название соли металла: Химическая формула соли металла: Концентрация раствора щелочи (NaOH) С NaOH = _________ Концентрация раствора трилона Б С Т = ___________ Объем аликвоты, взятый для анализа Vа = _______мл. Таблица экспериментальных данных
Обработка результатов эксперимента 1. Рассчитать исходную и равновесные концентрации металла (2+) по уравнению:
где V T и С Т – объем, мл и концентрация, моль/л трилона Б, Va – объем аликвоты, мл. 2. Вычислить концентрацию металла (2+) в органической фазе по уравнению:
где 3. Рассчитать коэффициент распределения
4. Заполнить таблицу:
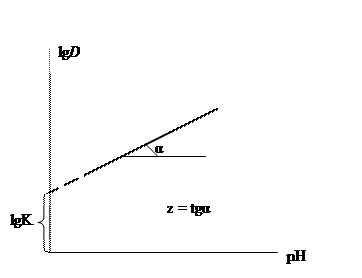
5. Построить график зависимости lg D Me = f (pH). 6. По графику определить коэффициенты K (константу равновесия) и z уравнения зависимости логарифма коэффициента распределения от рН: lg D = lg K + z pH
7. Сравнить полученную величину z с зарядом иона и сделать вывод о справедливости принятой модели. 8. Сравнить значения lg K для других металлов и сделать вывод о сравнительной экстрагируемости катионов металлов нафтеновыми кислотами. Содержание отчета по лабораторной работе 1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. Электропроводность растворов электролитов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 414; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.144.162 (0.007 с.) |

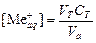 ,
, ,
,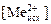 и V исх - концентрация, моль/л, и объем, мл, исходной соли металла, взятой для экстракции; Vaq – объем водной фазы, мл, Vaq = V исх + V NaOH; Vorg – объем органической фазы, мл.
и V исх - концентрация, моль/л, и объем, мл, исходной соли металла, взятой для экстракции; Vaq – объем водной фазы, мл, Vaq = V исх + V NaOH; Vorg – объем органической фазы, мл.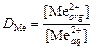 .
.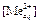 , моль/л
, моль/л
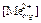 , моль/л
, моль/л