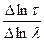Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование процесса адсорбции уксусной кислотыСтр 1 из 2Следующая ⇒
Кафедра химии
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ К ЛАБОРАТОРНОМУ ПРАКТИКУМУ ПО ДИСЦИПЛИНЕ «ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ» (КОЛЛОИДНАЯ ХИМИЯ)
Специальности: 240301 - Химическая технология неорганических веществ, 280201 – Охрана окружающей среды и рациональное использование природных ресурсов
ЧЕРЕПОВЕЦ
Рассмотрено на заседании кафедры химии, протокол № 5 от 16.01.2006 г. Одобрено редакционно-издательской комиссией Факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 2 от 17.01.2006 г.
С о с т а в и т е л и: Г.А. Котенко, канд. хим. наук, доцент О.В. Ульянова
Р е ц е н з е н т ы: Е.А. Шестакова, канд. техн. наук, доцент (ГОУ ВПО ЧГУ); С.Н.Балицкий, канд. хим. наук, доцент (ГОУ ВПО ЧГУ)
Н а у ч н ы й р е д а к т о р: Г.А. Котенко, канд. хим. наук, доцент
У Котенко Г.А., Ульянова О.В., 2006
В В Е Д Е Н И Е Коллоидная химия, как и химия вообще, является в большой степени наукой экспериментальной. Для овладения ею недостаточно только теоретической подготовки, знания идей и законов науки. Необходимо также приобретение навыков экспериментального исследования, что требует освоения современных приборов, умения обработать результаты эксперимента и сделать соответствующие выводы и заключения. Настоящий лабораторный практикум по коллоидной химии рассчитан на студентов химико-технологических и экологических специальностей вузов и представлен в объеме, соответствующему учебному плану. Он содержит 6 лабораторных работ с теоретической и экспериментальной частью, контрольными вопросами, библиографией и охватывает наиболее важные разделы курса. Работы 1, 2, 4, 5, 6 составлены Котенко Г.А., работа 3 – Ульяновой О.В. Методические указания: 1. Перед выполнением работы сдать допуск. 2. Оформить отчеты по работам на отдельных сброшюрованных листах. 3. Выполнить экспериментальную часть лабораторной работы, заполнить таблицу экспериментальных данных. 4. Произвести расчеты в соответствии с приведенными алгоритмами, построить графики на миллиметровой бумаге, заполнить таблицу результатов расчетов.
5. Сформулировать выводы в виде комментариев по результатам расчетов и графическим зависимостям. 6. Завершить оформление отчетов, подготовиться к защите лабораторных работ по контрольным вопросам, воспользовавшись теоретическими положениями, имеющимися в настоящем практикуме, а также в учебных пособиях в соответствии с приведенным списком литературы. РАБОТА 1 ИССЛЕДОВАНИЕ ПРОЦЕССА АДСОРБЦИИ УКСУСНОЙ КИСЛОТЫ ИЗ ВОДНЫХ РАСТВОРОВ НА АКТИВИРОВАННОМ УГЛЕ Цель работы: Формирование навыков экспериментального изучения явления адсорбции на границе раствор – твердое тело, получение изотермы адсорбции, расчет геометрических и термодинамических характеристик. Теоретическая часть Адсорбция представляет собой процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Более плотная фаза (вещество, на поверхности которого происходит адсорбция) называется адсорбентом. Адсорбент может быть твердым и жидким. Вещество, которое перераспределяется и поэтому находится обычно в газообразной или жидкой фазе, называется адсорбатом. В зависимости от агрегатного состояния смежных фаз различают адсорбцию газов на твердых адсорбентах, адсорбцию растворенных веществ на границах твердое тело жидкость и жидкость – жидкость, а также адсорбцию на границе жидкий раствор – газ. Для количественного описания адсорбции применяют в основном две величины. Первая измеряется числом моль или граммов, приходящихся на единицу поверхности или на единицу массы адсорбента (для порошкообразного состояния); ее принято обозначать буквой А. Вторая характеристика величины адсорбции определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы, также отнесенным к единице площади поверхности или единице массы адсорбента. Эту величину называют гиббсовской адсорбцией и обозначают буквой Г. Величина адсорбции зависит от природы адсорбента и адсорбата, а также от концентрации (давления) адсорбата и температуры. Зависимость величины адсорбции от концентрации (или парциального давления) вещества при постоянной температуре называется изотермой:
А = Зависимость величины адсорбции от температуры при постоянной концентрации (или парциальном давлении) вещества называется изопикной (изобарой): А = Зависимость концентрации (или парциального давления) вещества в объеме от температуры при постоянной величине адсорбции называется изостерой: С = Наиболее распространенной зависимостью, получаемой экспериментально, является изотерма. Другие две зависимости можно графически построить из серии изотерм, полученных при различных температурах. На рис. I показано, что точки пересечения изотерм прямой, параллельной оси ординат соответствуют изопикне, а при пересечении изотерм прямой, параллельной оси абсцисс, получаются точки изостеры. По полученным точкам строят зависимости величины адсорбции (изопикна) или концентрации (изостера) от температуры.
Рис. 1 Построение изостер С термодинамической точки зрения адсорбция является самопроизвольным процессом выравнивания химических потенциалов веществ в объеме системы и межфазном (поверхностном) слое. Этот процесс происходит вследствие стремления к минимуму поверхностной энергии или энергии Гиббса всей системы. Адсорбцию можно рассматривать как взаимодействие молекул адсорбата с активными центрами поверхности адсорбента. Такое рассмотрение удобно для адсорбции на твердых адсорбентах. Поверхность твердых тел как правило геометрически и химически неоднородна, и чтобы получить простейшие закономерности адсорбции, необходимо предположить, что поверхность адсорбента однородна и распределение адсорбата происходит в мономолекулярном слое. Тогда при малых концентрациях адсорбента изотерма адсорбции описывается законом Генри: А = КгС или А = КгР. При средних и больших концентрациях адсорбата возникают отклонения от закона Генри, связанные с ограниченностью адсорбционного объема или поверхности адсорбента, приводящей к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации адсорбата. Уравнение изотермы адсорбции, полученное Ленгмюром, описывает все области концентраций (парциальных давлений) адсорбата (рис.2): А = где Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
Такая линейная зависимость позволяет графически определить оба постоянных параметра адсорбционной изотермы (рис.3).
Рис.2 Изотерма адсорбции Ленгмюра
Рис.3 Изотерма адсорбции в координатах линейной формы уравнения Ленгмюра.
В области средних концентраций (парциальных давлений) изотерма адсорбции Ленгмюра подчиняется закономерности, найденной эмпирически Фрейндлихом: А = КР1/n и A = KC1/n. где К и 1/n – постоянные. Уравнение Фрейндлиха широко используется при обработке экспериментальных адсорбционных данных и инженерных расчетах. Чаще всего оно применяется в логарифмической форме, позволяющий построить линейную зависимость lnA = f (ln C) и графически определить оба постоянных параметра К и n (рис.4):
lnA = ln K +
Рис. 4. Изотерма адсорбции в координатах линейной формы уравнения Фрейндлиха.
Уравнение Ленгмюра используется для определения удельной поверхности адсорбентов, катализаторов и других дисперсных систем. Удельная поверхность Sуд. связана с емкостью монослоя Sуд. = где NA – число Авогадро; S0 –площадь, занимаемая одной молекулой адсорбанта в насыщенном адсорбционном слое. Стандартная энергия Гиббса адсорбции связана с константой равновесия адсорбции из уравнения Ленгмюра соотношением: ΔG0 = - RTlnK. Экспериментальная часть Приборы и реактивы: Весы технические; колбы конические, емкостью 100 мл; пипетки Мора, емкостью 10, 20, 50 мл; уголь активированный; воронки и фильтры; бюретка, емкостью 25 мл; раствор уксусной кислоты 0,1 н; стандартный раствор едкого натрия 0,1 н; раствор фенолфталеина. Порядок выполнения работы Определяют концентрацию исходного раствора уксусной кислоты посредством титрования стандартным раствором едкого натрия в присутствии фенолфталеина. Результаты титрования записывают в таблицу 1. Таблица 1.
Из исходного раствора кислоты готовят 5 водных растворов в соответствии с данными таблицы 2: Таблица 2
Кислоту и воду необходимо отбирать пипетками. Берут 5 навесок предварительно измельченного активированного угля по 1 г. В растворы кислоты вносят навески адсорбента и встряхивают в течении 10 минут. Затем растворы отфильтровывают, отбирают аликвоты по 10 мл и титруют стандартным раствором щелочи. Данные заносят в таблицу 3. Таблица 3
РАБОТА 2 НА ГРАНИЦЕ РАСТВОР-ВОЗДУХ Цель работы: Формирование навыков исследования поверхностной активности, адсорбции ПАВ, получение изотермы поверхностного натяжения, определение параметров адсорбционного слоя на границе раствор – воздух.
Теоретическая часть Фактором интенсивности поверхностной энергии является поверхностное натяжение, обусловленное не скомпенсированным полем межмолекулярных сил на межфазной поверхности. Из фундаментальных уравнений Гиббса для гетерогенных систем относительно термодинамических потенциалов U, H, F, и G следует, что поверхностное натяжение определяется как частные производные:
Наиболее часто поверхностное натяжение выражают через производную энергии Гиббса, т.к. условия Р,Т = const легко осуществимы экспериментально. Единицы измерения При добавлении в водные растворы поверхностно-активных веществ (ПАВ) их поверхностное натяжение на границе раствор-воздух резко снижается. Типичные ПАВ имеют ассиметрично построенные молекулы, состоящие из двух частей: активной полярной группы, хорошо взаимодействуют с молекулами воды, типа -ОН, -ОСОН, -NH2, -NO2, -SO3H, -SO3Na, -COONa и др., и неполярной гидрофобной группы – углеводородного радикала. Такие дифильные молекулы способны взаимодействовать одновременно с полярными и неполярными средами, самопроизвольно накапливаться на границе раздела фаз, понижая энергию Гиббса поверхности и образуя адсорбционный слой определенной структуры. В адсорбционных слоях молекулы ПАВ ориентируются полярными группами в сторону полярной среды (воды), а неполярной гидрофобной частью – в сторону менее полярной фазы (воздуха, углеводородной жидкости) (рис.5). Величины адсорбции компонентов Гi и поверхностное натяжение связаны между собой уравнением Гиббса: -d Г = - ПАВ имеют
Рис.5 Ориентация дифильных молекул ПАВ на границе двух сред. Поверхностно-инактивные вещества (ПИнАВ) имеют
Рис.6 Изотерма поверхностного натяжения и адсорбции Гибсса Для определения
При малых концентрациях адсорбция Г Приведение данного уравнения к линейной форме: позволяет графически определить постоянные параметры
Рис.7. Изотерма адсорбции в координатах линейной формы уравнения Гиббса при малых концентрациях адсорбата.
Площадь, приходящуюся на одну молекулу в насыщенном адсорбционном слое, вычисляют по уравнению:
Толщину адсорбционного слоя δ рассчитывают по формуле: δ = где М – молекулярная масса ПАВ; ρ – плотность ПАВ. Радиус шарообразных молекул равен Г = Экспериментальная часть Приборы и реактивы: Прибор Ребиндера для определения поверхностного натяжения, мерные колбы объемом 25 мл, микропипетки, ПАВ.
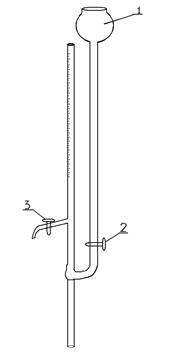
Порядок выполнения работы Экспериментальные исследования заключаются в определении поверхностного натяжения растворов различных концентраций. Для определения поверхностного натяжения используется метод Ребиндера. Этот метод основан на положении, что поверхностное натяжение на границе раствор-воздух пропорционально давлению, необходимому для отрыва пузырька от капиллярного кончика в исследуемую жидкость. На рис.8 приведен прибор Ребиндера. В пробирку l наливается исследуемый раствор таким образом, чтобы кончик капилляра К касался ее поверхности. Пробирка и бутыль А плотно закрываются пробками, затем медленно, по каплям пускается вода из бутыли А так, чтобы из кончика капилляра К в исследуемую жидкость проскакивали равномерно пузырьки воздуха.
Рис. 8 Прибор Ребиндера
По манометру Т берут максимальную алгебраическую сумму уровней Р, наливая последовательно в пробирку сначала дистиллированную воду, а затем растворы ПАВ в порядке возрастания концентрации в соответствии с вариантами согласно табл.5 Таблица 5
В качестве ПАВ используются пропиловый, бутиловый, амиловый спирт или другие вещества по указания преподавателя. Экспериментальные данные записываются в таблицу 6. Таблица 6
МПАВ = г/моль; ρПАВ = г/м3. Константы для расчетов: NA = 6,05 .1023 молекул/моль. Вопросы допуска. 1. Какова цель работы? 2. Опишите прибор Ребиндера. Какова методика работы с ним? 3. Расскажите порядок выполнения эксперимента. 4. Какие эмпирические данные необходимо получить в работе? 5. Дайте алгоритм расчета результатов. 6. Какие графические зависимости необходимо построить? 7. Как графически рассчитываются величины Контрольные вопросы. 1. Что такое поверхностное натяжение и в каких единицах оно измеряется? 2. Как зависит поверхностное натяжение от природы вещества, образующего поверхность (межмолекулярного взаимодействия)? 3. Напишите фундаментальное адсорбционное уравнение Гиббса и дайте определение избыточной адсорбции. 4. Каково соотношение между избыточной Г и абсолютной адсорбциями А? В каких случаях можно принять А 5. Как рассчитать толщину адсорбционного слоя и посадочную площадку молекул ПАВ, зная зависимость 6. Чем определяется площадь молекулы в адсорбционном слое? РАБОТА 3 СТАЛАГМОМЕТРИЧЕСКИМ МЕТОДОМ Цель работы: Формирование навыков исследования поверхностной активности, построение изотерм поверхностного натяжения. Теоретическая часть Величину g = – (dσ/dС)С g = - ( Поверхностную активность вещества обычно определяют при бесконечно малой концентрации раствора; в этом случае величина g зависит только от природы ПАВ и растворителя. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило: В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу -СН2 увеличивает поверхностную активность в 3 – 3,5 раза.
Рис.9 Ориентация молекул ПАВ в поверхностном слое.
Молекулы большинства ПАВ обладают дифильным строением, т.е. содержат как полярную группу, так и неполярный углеводородный радикал. Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии ориентации молекул полярной группой к полярной фазе (полярной жидкости), а неполярной – к неполярной фазе (газу или неполярной жидкости). При малой концентрации раствора тепловое движение нарушает ориентацию молекул ПАВ; при повышении концентрации происходит насыщение адсорбционного слоя и на поверхности раздела фаз образуется слой "вертикально" ориентированных молекул ПАВ (рис.9). Образование такого мономолекулярного слоя соответствует минимальной величине поверхностного натяжения раствора ПАВ и максимальному значению адсорбции Г; при дальнейшем увеличении концентрации ПАВ в растворе поверхностное натяжение и адсорбция не изменяются. Экспериментальная часть Приборы и реактивы: Сталагмометр (микробюретка); мерные колбы на 25 см3; микропипетки; спирты. Порядок выполнения работы Поверхностное натяжение растворов определяют сталагмометрическим методом, который заключается в отсчете капель при медленном вытекании исследуемой жидкости из капилляра. В данной работе используется относительный вариант метода, когда одна из жидкостей (дистиллированная вода), поверхностное натяжение которой при данной температуре точно известно, выбирается в качестве стандартной. В качестве ПАВ используют этиловый, изобутиловый, изопропиловый или др. спирт по указанию преподавателя. В данной работе используются разбавленные растворы в порядке возрастания концентрации в соответствии с вариантами: I – 0,6; 1,0; 1,4; 1,8; 2,2 %. II - 0,4; 0,8; 1,2; 1,6; 2,0 %.
Рис. 10. Сталагмометр
Сталагмометр (микробюретка) (рис.10) представляет собой 2 стеклянные трубки соединенные между собой. В резервуар 1 наливается исследуемый раствор, затем открывают кран 2, при этом заполняются стеклянные трубки. Когда они заполнятся, кран перекрывают. Затем медленно открывают кран 3 (уровень жидкости должен быть выше верхней метки) и дают жидкости по каплям вытекать из сталагмометра в стаканчик. Скорость истечения можно регулировать при помощи крана. Когда уровень жидкости достигнет верхней метки, начинают отсчет капель, отсчет продолжают до достижения уровнем нижней метки. Эксперимент повторяют 3 раза для каждого раствора. Результаты экспериментов для каждого из двух спиртов заносят в таблицу 8: Таблица 8 Спирт 1 Спирт 2
Вопросы допуска 1. Какова цель работы? 2. Опишите сталагмометр. Какова методика работы с ним? 3. Расскажите порядок выполнения эксперимента. 4. Какие эмпирические данные необходимо получить в работе? Контрольные вопросы 1. Что такое поверхностная активность? Какие вещества называются ПАВ? 2. Как выглядят изотермы поверхностного натяжения для ПАВ и ПинАВ? 3. Расскажите об ориентации дифильных молекул ПАВ на границах двух сред. 4. Сформулируйте правило Дюкло-Траубе и поясните его физический смысл. В чем заключается обратимость этого правила?
РАБОТА 4 Теоретическая часть Из оптических методов исследования в коллоидной химии применяются те методы, с помощью которых можно определять размер и форму частиц, удельную поверхность, концентрацию дисперсной фазы. К таким методам относится световая и электронная микроскопия, методы, основанные на рассеянии лучей, двойном лучепреломлении и др. Электронная микроскопия применима только для исследования сухих образцов. Для исследования образцов в жидких средах используются оптические методы, основанные на рассеивании света. Светорассеяние или опалесценция принадлежат к дифракционным явлениям, обусловленным неоднородностями, размеры которых меньше длины волны падающего света. Такие неоднородности рассеивают свет во всех направлениях. Теория светорассеяния впервые была развита Рэлеем. В ее основе лежит уравнение интенсивности света, рассеянного единицей объема дисперсной системы со сферическими диэлектрическими частицами, значительно меньшими длины волны падающего света: Jp = J0 где J0 - интенсивность падающего света; F – функция показателей преломления; ν – концентрация частиц в единице объема; υ – объем частицы; λ – длина волны падающего света; R – расстояние частицы от источника света; Θ – угол между направлениями распространения падающего и рассеянного света. Функция F определяется соотношением: F = 24 π 3 где n1 и n0 – соответственно показатель преломления вещества дисперсной фазы и дисперсной среды. Уравнение Рэлея лежит в основе оптических методов определения размеров частиц и концентраций дисперсной фазы: ультрамикроскопии, нефелометрии и турбидиметрии. Ультрамикроскопия от обычной микроскопии отличается тем, что объект (дисперсная система) освещается сбоку, а наблюдают рассеянный свет. Вследствие этого частицы кажутся светящимися точками на темном фоне, и разрешающая сила микроскопа резко возрастает, что позволяет наблюдать частицы диаметром до 2 - 3 нм. Нефелометрия – метод исследования, при котором измеряют интенсивность рассеянного света, падающего на кювету с дисперсной системой. Соотношение Рэлея при данной длине волны и Θ = const записывается: Jp = J0kνυ2 = J0 kcυ. где k – константа; с = νυ – объемная концентрация дисперсной фазы. Турбидиметрия основана на измерении интенсивности проходящего через дисперсную систему света. Рассеянный свет можно считать условно поглощенным, и поэтому можно принять, что закономерности рассеяние света подчиняются уравнению Бугера-Ламберта-Бера: lg где J – интенсивность света, прошедшего через систему; D = lg Мутность τ = С увеличением размеров частиц закон Рэлея перестает соблюдаться. В этом случае можно пользоваться эмпирическими соотношениями. В частности, если диаметр частиц составляет от 1/10 до 1/3 длины световой волны и показатели преломления частиц и среды не сильно различаются можно пользоваться эмпирическим уравнением Геллера: D = kλ-k или τ = k | λ-k, где k и k| - константы, не зависящие от длины волны. Зависимость lg D (или lg τ) от lg λ в соответствии с данными уравнениями представляют собой прямую линию, тангенс угла наклона которой равен показателю n с минусом. Значение показателя в этих уравнениях зависит от соотношения между размером частицы и длиной волны падающего света, характеризуемого параметром: z = επr/λ Значения k для z от 2 до 8 даны в таблице 9.
Таблица 9
Показатель степени k в уравнении находят на основе турбидиметрических данных. Для этого экспериментально измеряют оптическую плотность золя при двух длинах волн и находят мутность τ: τ = Затем для двух значений длин волн определяют k: k = - Определив по таблице 1 соответствующее значение z находят средний радиус частиц дисперсной фазы: r = Этот метод, как и уравнения Рэлея, применим только для «белых» золей, т.е. неокрашенных дисперсных систем. Экспериментальная часть Приборы и реактивы: Фотоэлектроколориметр ФЭК-56 М, мерные цилиндры объемом 5 мл, колбы конические объемом 50 мл; раствор 1 (1,1 г Na2SO4 . 10H2O в 50 мл глицерина); раствор 2 (2,45 г BaCl2 . 2H2O в 50 мл глицерина), этиловый спирт. Порядок выполнения работы Заданное количество растворов 1 и 2 помещают в конические колбы, разбавляют спиртом и водой в определенном соотношении. В кювету, толщиной 3-5 см, осторожно выливают из колб растворы, полученные разбавление из 1 и 2. В зависимости от соотношения спирта и воды при разбавлении получают золи с различной величиной частиц. Рекомендуется одно из следующих трех разбавлений:
1 мл раствора 2 + 5 мл воды + 4 мл спирта. 2. 1 мл раствора 1 + 2 мл воды + 3 мл спирта, 1 мл раствора 2 + 2 мл воды + 3 мл спирта. 3. 1 мл раствора 1 + 1,5 мл воды + 3,5 мл спирта, 1 мл раствора 2 + 1,5 мл воды + 3,5 мл спирта.
На фотоэлектроколориметре ФЭК-56 М определяют значение оптической плотности D золя, полученного в кювете, используя красный и синий светофильтры. Кюветы для растворителя заполняют дистиллированной водой. Результаты эксперимента записывают в таблицу 10: Таблица 10
l = Вопросы допуска 1. Какова цель работы? 2. На какой теоретической закономерности основан данный метод исследования? 3. Какая дисперсная система исследуется в работе? 4. Расскажите о порядке выполнения экспериментальной части, методике работы с прибором ФЭК-56М. 5. Какие экспериментальные данные необходимо получить в работе? 6. Дайте алгоритм расчета результатов. Контрольные вопросы 1. Каковы признаки объектов коллоидной химии? 2. Каковы количественные характеристики раздробленности? 3. Как классифицируются дисперсные системы по кинетическим свойствам дисперсной фазы? Какова классификация свободнодисперсных систем? 4. Какие оптические явления происходят при падении луча света на дисперсную систему? Какие методы исследования дисперсных систем основаны на этих явлениях? 5. Какие оптические методы используются для определения размеров частиц дисперсной фазы? 6. Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами количественно характеризуется рассеяние света в системе? 7. Какие золи называют «белыми»? Какова связь между оптической плотностью и мутностью «белых» золей? Для каких дисперсных систем применимо уравнение Рэлея? 8. Как влияют размеры частиц на зависимость оптической плотности «белых» золей от длины волны падающего света? 9. Чем различаются методы нефелометрии и турбидиметрии? Какие уравнения используются для характеристик рассеяния света?
РАБОТА 5 Теоретическая часть Либофобные дисперсные системы термодинамические неустойчивы, так как частицы дисперсной фазы склонны к агрегации. Их термодинамическая агрегативная неустойчивость обусловлена избытком поверхностной энергии. Межфазное поверхностное натяжение в лиофобных системах больше рассчитанного по соотношению Ребиндера-Щукина. δmax = γkT/a2, где γ – безразмерный коэффициент, k – константа Больцмана, a - средний размер частиц. Поэтому такие системы не могут быть получены самопроизвольным диспергированием; для их образования должна быть затрачена энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости чаще всего происходит за счет слипания частиц - коагуляции. Агрегативная устойчивость коллоидных систем обуславливается термодинамическими и кинетическими факторами. Термодинамические факторы, действие которых направлено на снижение поверхностного натяжения и увеличение энтропии, уменьшают вероятность эффективных соударений между частицами, создают потенциальные барьеры. Кинетические факторы снижают скорость столкновения частиц и связаны в основном с гидродинамическими свойствами системы. Различают следующие факторы устойчивости (стабилизации) дисперсных систем. Термодинамические: - Электростатический фактор: заключается в уменьшении поверхностного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана: dδ/dφ = - qS, где φ – электрический потенциал, qS – плотность заряда поверхности; - Адсорбционно–сольватный фактор: состоит в уменьшении поверхностного натяжения в результате взаимодействия частиц с дисперсной средой по уравнению Дюпре: Wa = δ2,1 + δ3,1 + δ2,3 где Wa – работа адгезии (прилипания) на границе жидкость – твердое тело; δ2,1 - поверхностное натяжение на границе жидкость – газ; δ3,1 - поверхностное натяжение на границе твердое тело-газ;
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 686; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.220.114 (0.199 с.) |
 У ГОУ ВПО Череповецкий государственный университет, 2006
У ГОУ ВПО Череповецкий государственный университет, 2006 .
. .
. или Р =
или Р =  .
.
 по изотермам.
по изотермам. или А =
или А =  .
.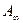 - емкость адсорбционного монослоя или число адсорбционных центров, приходящихся на единицу поверхности или на единицу массы адсорбента; К – константа адсорбционного равновесия, характеризует энергию взаимодействия адсорбата с адсорбентом.
- емкость адсорбционного монослоя или число адсорбционных центров, приходящихся на единицу поверхности или на единицу массы адсорбента; К – константа адсорбционного равновесия, характеризует энергию взаимодействия адсорбата с адсорбентом. .
.

 ln C.
ln C.

 в СИ [Дж/м2] или [н/м]. Чем сильнее межмолекулярные связи в данном теле, тем больше поверхностное натяжение. Поверхностное натяжение меньше у неполярных жидкостей, имеющих слабые межмолекулярные связи и больше у полярных.
в СИ [Дж/м2] или [н/м]. Чем сильнее межмолекулярные связи в данном теле, тем больше поверхностное натяжение. Поверхностное натяжение меньше у неполярных жидкостей, имеющих слабые межмолекулярные связи и больше у полярных. , где
, где 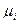 - химический потенциал компонентов. При малых концентрациях адсорбента в бинарном растворе приведенное соотношение переходит в следующее уравнение:
- химический потенциал компонентов. При малых концентрациях адсорбента в бинарном растворе приведенное соотношение переходит в следующее уравнение: .
. < 0 и Г > 0, они накапливаются на межфазной поверхности.
< 0 и Г > 0, они накапливаются на межфазной поверхности.

 = -
= -  А и уравнение Ленгмюра может быть записано в виде:
А и уравнение Ленгмюра может быть записано в виде:  .
.
 и К адсорбционной изотермы (рис. 7)
и К адсорбционной изотермы (рис. 7)

 .
. .
. .
.
 = 72,75 . 103 Дж/м2; R = 8,31 Дж/моль . К;
= 72,75 . 103 Дж/м2; R = 8,31 Дж/моль . К;
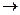 0 называют поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации Сi определяют графически, проводя касательную к изотерме поверхностного натяжения; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:
0 называют поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации Сi определяют графически, проводя касательную к изотерме поверхностного натяжения; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций: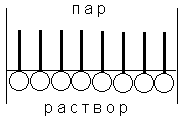

 ,
, .
.
 - оптическая плотность; τ – мутность системы; l – толщина системы.
- оптическая плотность; τ – мутность системы; l – толщина системы. и оптическая плотность D в соответствии с уравнением Рэлея пропорциональны концентрации и квадрату объема частиц. Это позволяет определять размеры частиц по оптической плотности методом сравнения со стандартными системами с помощью фотоэлектроколориметра.
и оптическая плотность D в соответствии с уравнением Рэлея пропорциональны концентрации и квадрату объема частиц. Это позволяет определять размеры частиц по оптической плотности методом сравнения со стандартными системами с помощью фотоэлектроколориметра. .
.