
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение молярной концентрации эквивалента и массы дихромата калия в растворе.Содержание книги
Поиск на нашем сайте
Цель работы: Научиться использовать перманганатометрическое титрование для определения окислителей способом обратного титрования. Задание: Определить массу дихромата калия обратным перманганатометрическим титрованием в контрольной задаче, выданной преподавателем. Оборудование и реактивы: Бюретка, мерная колба вместимостью 100 мл, пипетка Мора, колба для слива, колбы конические для титрования, воронка, резиновая груша. Растворы перманганата калия, соли Мора. Сущность работы: Дихромат калия является сильным окислителем и не может реагировать с перманганатом калия. Титриметрическое определение его может быть осуществлено перманганатометрическим титрованием. Для этого в качестве восстановителя берут раствор соли железа (II). Наиболее часто применяют для этой цели соль Мора
Формула закона эквивалентов для данного обратного титрования:
где с(FeSO4)V(FeSO4) = c(1/5 KMnO4) Vхол (KMnO4) Сделав подстановку, получаем формулу: с(1/6 K2Cr2O7) V аликв.доли(K2Cr2O7) + c(1/5 KMnO4) V(KMnO4)осн= c(1/5 KMnO4)Vхол(KMnO4)
c(1/5 KMnO4) [ Vхол (KMnO4) - V осн(KMnO4) ] M (K2Cr2O7) Vмерной колбы m (K2C2O7) = ------------------------------------------------------------------------------------- 6 V аликвотной доли Выполнение эксперимента: 1.Готовят бюретку к работе. 2. Готовят пробы анализируемого раствора для определения. 3. Титруют остаток соли Мора, не вступивший в реакцию с дихроматом калия. 4. Проводят холостой опыт. 5. Рассчитывают массу дихромата калия в анализируемом растворе. Экспериментальные данные: Концентрация титранта Объем анализируемого раствора после разбавления: _______________________________ Аликвотная доля анализируемого раствора Точно отмеренный объем подкисленного раствора соли Мора: 10 мл
Результаты титрования:
Расчеты: *В выводах указывают полученный результат, метод исследования. Вычисляют относительное отклонение от массы дихромата калия, указанной преподавателем. Вывод: Дата _______ Занятие ___________ МОДУЛЬ №02. Химическая термодинамика. Энергетика химических реакций. I начало термодинамики. Энтальпия. Закон Гесса. Задания для самостоятельной работы 2.19; 2.45; 2.57; 2.61
Дата _______ Лабораторная работа 3.1 Определение стандартной энтальпии реакции нейтрализации.
Цель работы: Научиться калориметрически определять энтальпии реакции нейтрализации. Приборы, оборудование и реактивы: Макет калориметра, термометр с ценой деления 0,1о(10), мерные цилиндры, растворы кислоты и основания. Сущность работы: Теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы. Лабораторный калориметр
1 – стакан, находящийся в большом термоизоляционном стакане 2, снабженном крышкой 3. С внутренним пространством калориметрического стакана контактируют воронка; и химический термометр 5. Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция: Н+(aq) + ОН–(aq) = Н2О(ж); DН°r = -57,3 кДж/моль. В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания. Выполнение эксперимента: 1. Измеряют температуру исходных растворов кислоты и щелочи. 2. Измеряют температуру раствора после проведения реакции. Экспериментальные данные.
Концентрации растворов кислоты ________ моль /л, щелочи_______ _ моль /л, Объемы растворов реагирующих веществ мл_____ Плотности растворов_______________г/мл_ Масса калориметрического стакана г Справочные величины Суд (воды) = 4,184 Дж/г×К Суд (стекла) = 0,753 Дж/г × К
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 724; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.153.171 (0.009 с.) |

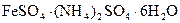 . Последовательно проводят реакции восстановления дихромата контролируемым избытком соли Мора в процессе титрования уже подкисленным перманганатом калия:
. Последовательно проводят реакции восстановления дихромата контролируемым избытком соли Мора в процессе титрования уже подкисленным перманганатом калия:

 ,
,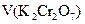 – аликвотная доля определяемого вещества,
– аликвотная доля определяемого вещества,  – точно отмеренный объем восстановителя, взятого в избытке,
– точно отмеренный объем восстановителя, взятого в избытке, 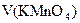 – объем титранта, затраченного на окисление избытка восстановителя. Концентрацию соли Мора заранее обычно не определяют. Вместо этого в ходе анализа раствора дихромата калия проводят холостые опыты, в которых отмеривают такие же объемы раствора соли Мора и титруют без добавления аликвотной доли раствора
– объем титранта, затраченного на окисление избытка восстановителя. Концентрацию соли Мора заранее обычно не определяют. Вместо этого в ходе анализа раствора дихромата калия проводят холостые опыты, в которых отмеривают такие же объемы раствора соли Мора и титруют без добавления аликвотной доли раствора  . В этом случае:
. В этом случае: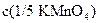 = ______________________
= ______________________ : 5 мл.
: 5 мл.



