
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной формСодержание книги
Поиск на нашем сайте Цель: Изучить зависимость величины редокс-потенциала от соотношения концентраций окисленной и восстановленной форм. Задание: Определить величины редокс-потенциала системы гексацианоферрат (Ш)/ гексацианоферрат (П) при соотношении концентраций 1:1; 10:1; 1:10. Оборудование и реактивы: Иономер ЭВ-74, электроды платиновый и хлорсеребряный; химические стаканы, бюретка. Водные р-ры гексацианоферрата (Ш) калия, гексацианоферрата(П) калия, хлорида калия. Термометр. Сущность работы: Для определения редокс-потенциалов собирают гальваническую цепь, состоящую из редокс-электрода и хлорсеребря║ного электрода. По измеренным величинам ЭДС рассчитываеют величины редокс-потенциалов. Изменяя соотношение концентраций окисленной и восстановленной форм, определяют величины редокс-потенциалов и выявляют зависимость их от этого фактора. Выполнение эксперимента: 1.Готовят иономер ЭВ-74 к работе. 2. Рассчитывают, какие требуются объемы растворов K4[Fe(CN)6] и K3[Fe(CN) с концентрациями 0,01 моль/л для приготовления трех систем по 11 мл с соотношением окисленной и восстановленной форм, равным: 1) 10:1 2) 1:1 3) 1:10 3.Измеряют ЭДС гальванической цепи. Схема гальванической цепи: Ag, AgCl │KCl║K3[Fe(CN)6], K4[Fe(CN)6] │ Pt 4. Рассчитывают величину редокс-потенциала. Найденные значения записывают в таблицу:
Обработка результатов эксперимента: Значение редокс-потенциалов рассчитывают по уравнению: φr = Е + φ срав после чего записывают в таблицу. Рассчитывают значения редокс-потенциалов для изученных систем по уравнению Нернста. Для расчетов можно применять уравнение: 2,303 RT a(ox) φr = φr° + ---------- lg ------- nF a(red) Расчёты: * В выводе отмечают зависимость редокс-потенциала от соотношения концентраций компонентов. Объясняют причины отклонений экспериментально найденных значений потенциалов от рассчитанных. Сравнивают полученное значение φr° с теоретическим (см. табл. 20 приложения практикума). Вывод: Дата ________ Лабораторная работа 6.10 Изучение влияния лигандного окружения на редокс-потенциал Цель. Изучить зависимость редокс-потенциала от лигандного окружения центрального атома. Закрепить навыки потенциометрических измерений. Задание: Определить величины редокс-потенциала системы железа (Ш)/ железа (П) в присутствии гидрофосфат- и цианид-ионов. Оборудование и реактивы: Иономер ЭВ-74, электроды платиновый и хлорсеребряный; химические стаканы, бюретка. Водные р-ры гексацианоферрата (Ш) калия, гексацианоферрата(П) калия, хлорида калия, дигидрофосфата натрия, гидрофосфата натрия, хлорида железа и соль Мора (с=0,01 моль/л).Термометр. Сущность работы: Для определения редокс-потенциалов собирают гальваническую цепь, состоящую из редокс-электрода и хлорсеребряного электрода. По измеренным величинам ЭДС рассчитываеют величины редокс-потенциалов. Для выявления зависимости φr от лигандного окружения измеряют редокс-потенциал для систем, имеющих один и тот же центральный атом(железо), одинаковое соотношение концентраций окисленной и восстановленной форм, но отличающихся лигандным окружением(вода, гидрофосфат-ион, цианид-ион). Если константа устойчивости комплекса с восстановленной формой больше аналогичной величины для окисленной формы, то значение редокс-потенциала увеличится. Если константа устойчивости комплекса с окисленной формой больше аналогичной величины для восстановленной формы, то значение редокс-потенциала уменьшится. Выполнение эксперимента: 1.Готовят иономер ЭВ-74 к работе. 2. Готовят растворы, содержащие изучаемые редокс-системы. 3.Измеряют ЭДС гальванической цепи. Схема гальванической цепи: 1.Ag, AgCl │KCl║K3[Fe(CN)6], K4[Fe(CN)6] │ Pt 2. Ag, AgCl │KCl║[Fe(H2O)6]3+ / [Fe(H2O)6]2+│ Pt 3. Ag, AgCl │KCl║[Fe(HPO4)(H2O)4]+ / [Fe(HPO4)(H2O)4]│ Pt
4. Рассчитывают величину редокс-потенциала. Найденные значения записывают в таблицу:
Расчёты: *В выводе отмечают выявленную зависимость. теоретически обосновывают, используя значения констант нестойкости цианидных и гидрофосфатных комплексов с окисленной и восстановленной формой изучаемой редокс-системы. Сравнивают полученное значение φr° Fe3+/Fe2+ с теоретическим(табличным). Вывод: Дата ___________ Занятие __________ Задания для самостоятельной работы 8.106; 8.111; 8.113;8.115 Дата ________ Лабораторная работа 6.11
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 261; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

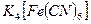 ,
с= 0,01 моль/л
,
с= 0,01 моль/л
 ,
с= 0,01 моль/л
,
с= 0,01 моль/л



