Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о ковалентной полярной связи.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
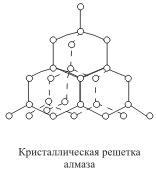
Простейшим примером полярной ковалентной связи может служить молекула хлороводорода HCl. Если молекула образована различными атомами, то молекулярное электронное облако смещается в сторону атома, имеющего наибольшую электроотрицательность. Такая ковалентная связь называется полярной. Например: В молекуле хлороводорода общая электронная пара смещена в сторону атома хлора. В результате у атома хлора возникает некоторый избыточный отрицательный заряд, а у атома водорода - заряд, равный по величине, но противоположный по знаку. Так, в молекуле с ковалентной полярной связью F2О электронная пара смещается к наиболее электроотрицательному атому фтора, отсюда у фтора будет заряд – 1, а у кислорода +2: Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4
В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием. Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис Большинство кристаллических органических соединений имеют молекулярную решетку.
Ионная химическая связь. Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.. Ионные кристаллические решетки. Катио́н — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4+ — однозарядный катион, Ca2+ — двузарядный катион. В электрическом поле катионы перемещаются к отрицательному электроду — катоду. Воздух-это пастбище жизни и сложная система химических и физических факторов. Воздух-это смесь газов, формирующая защитную оболочку вокруг Земли, называемую атмосферой. Воздух необходим для жизни на Земле – для дыхания и для питания растений. Воздух также защищает поверхность Земли от опасного ультрафиолетового излучения Солнца. Воздух состоит из азота- 78%, кислорода – 21%, других газов – 1%. У атома кислорода в наружной оболочке 6 электронов. Для того чтобы, стать устойчивым, ему необходимо наполнить свою оболочку ещё двумя электронами, поэтому молекула кислорода воздуха легко присоединяет к себе 1 или 2 свободных элементов, ионизируется и превращается в аэроион (анион) кислорода отрицательной полярности. Ионами называются атомы или молекулы, потерявшие или присоединившие электрон, из-за чего получили положительный или отрицательный заряд. В результате потери или присоединения одного или нескольких электронов атом становится ионом. Все ионы – электрически заряженные частицы. Заряд в ионе возникает из-за того, что количество положительно заряженных протонов и отрицательно заряженных электронов становится разным. Атом, потерявший электрон, делается положительно заряженным ионом – катионом. Атом, который приобрёл электрон, становится отрицательно заряженным ионом – анионом. В анионе больше электронов, чем протонов.
|
||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.195.30 (0.006 с.) |