
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение алканов, их гомологический рядСодержание книги
Поиск на нашем сайте
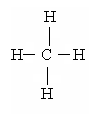
Предельными или насыщенными называются углеводороды, в молекулах которых атомы углерода С связаны простой (одинарной) σ-связью. Предельные углеводороды содержат максимальное количество атомов водорода.
 электронная формула структурная формула электронная формула структурная формула
СН3 - СН3
СН4метан СН3 метил С2Н6 этан С2Н5 этил С3Н8 пропан С3Н7 пропил С4Н10 бутан С4Н10 бутил С5Н12 пентан С5Н11 амил
Соединения, образующие гомологический ряд называются гомологами. Гомологи имеют сходное строение, общие химические свойства. Остатки углеводородов без одного или нескольких атомов водорода называются углеводородными радикалами или просто радикалами. Если радикал содержит всего на один атом водорода меньше чем алкан, то это одновалентный радикал. Общее название одновалентных радикалов - алкилы. Название радикалов образуют заменяя суффикс – ан на – ил -. В свободном состоянии радикалы не существуют. Общий состав одновалентных радикалов СnH2n+1. В общем виде обозначаются латинской буквой R. Изомерия алканов. Какие вещества называются изомерами? Изомерия алканов проявляется в структурной изомерии. Цепь углеродных атомов может быть прямая или разветвленная.

СН3 – СН2– СН2 – СН3
СН3 – СН– СН3 | СН3
С - третичный 2)
Номенклатура алканов. Рациональная – названия всех алканов образуются из названия простейшего члена гомологического ряда металла, к которой прибавляют обозначения углеводородных радикалов, замещающих в нем атомы водорода. Названия заканчиваются словом «метан», а радикал перечисляются в порядке усложнения. Современная заместительная номенклатура – углеводороды с разветвленной цепью рассматривают. Как производные нормальных алканов, в цепи которых вместо атомов Н стоят углеводородные радикалы. Выбирают самую длинную углеродную цепь, нумеруют в ней углеродные атомы с того конца цепи, к которой ближе ответвление. Записывают номера атомов углерода, при которых имеются ответвления (радикалы). Затем пишут названия радикалов в алфавитном порядке. После этого называют главную цепь.
Реакции замещения Легче всего происходит замещение водорода при третичном атоме водорода и труднее всего - при первичном. 1. Замещение галогеном. На солнечном свету или специальном освещении алканы вступают в реакцию замещения с галогенами, - легко с Cl2, Br2, очень трудно с J2, а F реакция идет со взрывом. RH + X2 → RX + HX Реакция идет постепенно CH4 + Cl2 → CH3Cl + HCl и т.д. Механизм реакции замещения на галоген имеет цепной свободно-радикальный характер. Как и все цепные реакции, она начинается с образования свободного радикала (инициирования реакции). Функцию инициатора в данном случае выполняет свет, под его воздействием молекула галогена распадается на свободные атомы - радикалы хлора.
В образовавшемся радикале хлора один из семи электронов является неспаренным и обладает высокой химической активностью. При его взаимодействии с электронным облаком атома водорода металла между этими атомами устанавливается ковалентная связь и образуется молекула хлороводорода и свободный радикал метил:
+ → +
свободный радикал метил
+
2. Нитрование Под действием разбавленной HNO3(при t, P) водород замещается на (NO2). Реакция Коновалова Н3С – Н + HОNO2 → Н3С - NO2 + Н2О
Окисление алканов При комнатной температуре предельные углеводороды устойчивы к действию окислителей, поэтому окраска КMnO4 не изменяется при добавлении к алканам. На воздухе предельные, как и почти все органические соединения горят с образованием оксида углерода, воды и большого количества теплоты. СН4 + 2О2 → СО2 + 2Н2О+ 882 к Дж. При каталитическом окислении при сравнительно не высоких температурах образуется кислородосодержащие соединения (спирты, кислоты). 2СН3 – (СН2)n+ СН3 + 3О2 → 2СН3 – (СН2)n – COOH +2Н2О Крекинг При температуре 3500С и выше с катализатором, или без катализатора происходит гомолитический разрыв связи С-С с образованием более простых углеводородов (предельных и непредельных). Такой процесс в технике называется крекинг.
С10Н22 При крекинге углеводородов, кроме расщепления углеродного скелета, протекает еще ряд процессов: дегидрирования, реакции присоединения, циклизация, изомеризация. При 10000С и выше идет более глубокий распад углеводородов (пиролиз), образуется углерод (сажа) и водород. С2Н6 Природные источники алканов Природный газ содержит 98% метана, а в качестве примесей этан, пропан и др. Попутный нефтяной газ более беден метаном (70-80%), этана (4-20%), пропана (5-22%), бутанов (5-20%), пентаны и др. Высшие алканы входят в состав нефтей. Метан СН4 – «болотный газ». Используется как топливо, а также как химическое сырье. Природный газ используют в следующих производствах: Получение сажи путем пиролиза метана: СН4 1 Получение ацетилена
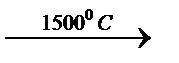 С2Н2 + 3Н2 С2Н2 + 3Н2
2 Окисление метана воздухом в присутствии катализатора СН3ОН, НСООН 4 Получение синильной кислоты 2СН4 + 2NH3 + 3O2 5 Хлорированием метана получают СН3Сl, СНСl3, ССl4.
Способы получения алканов 1 Синтез Вюрца (1855 г.) СН3J + 2Na + J - СН3→ СН3 - СН3 + 2NaJ 2 Гидрирование непредельных (катализаторы платина, палладий, никель) R – CH = CH – R’ Наиболее важный промышленный способ. 3 Прямой синтез из элементов. Метан образуется в вольтовой дуге между угольными электродами в присутствии водорода.
 CH4 CH4
4 Cплавлением солей одноосновных кислот со щелочами. В лабораторных условиях метан получают
СН3СООNa + NaОН→ CH4 + Na2СО3
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 482; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.163.26 (0.012 с.) |






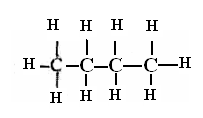



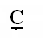

 - первичный у С5Н12 три изомера
- первичный у С5Н12 три изомера - вторичный 1) СН3 – СН2– СН2 – СН2 - СН3
- вторичный 1) СН3 – СН2– СН2 – СН2 - СН3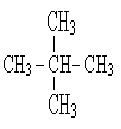 С - четвертичный 3)
С - четвертичный 3)
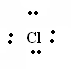



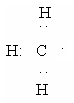
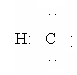
 Полученный радикал метил на первой стадии хлорирования отбирает от другой молекулы хлора атом хлора, что приводит к образованию хлористого метила и нового свободного радикала хлора:
Полученный радикал метил на первой стадии хлорирования отбирает от другой молекулы хлора атом хлора, что приводит к образованию хлористого метила и нового свободного радикала хлора: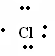
 С5Н10 + С5Н12
С5Н10 + С5Н12 2С + 3Н2
2С + 3Н2
 R – CH2 – CH2 – R’
R – CH2 – CH2 – R’


