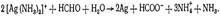Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обнаружение четыреххлористого углеродаСодержание книги
Поиск на нашем сайте
В химико-токсикологическом анализе для обнаружения четыреххлористого углерода ССЦ в дистиллятах применяют ряд реакций, большинство которых дают и другие хлорпроизводные углеводородов. Реакция отщепления хлора. Четыреххлористый углерод можно обнаружить по наличию в его молекуле атомов хлора. Реакция Фудживара. При нагревании СCl4 с пиридином в присутствии щелочи появляется красная окраска Реакция образования изонитрила. Четыреххлористый углерод при взаимодействии с анилином образует изонитрил, имеющий неприятный запах. Реакция с резорцином. При нагревании ССl 4 с резорцином в присутствии щелочи появляется розовая или малиново-красная окраска. Реакция с 2,7-диоксинафталином. Для обнаружения четыреххлористого углерода в дистиллятах, а также в различных технических жидкостях, содержащих указанный препарат, применяют реакцию с 2,7-диоксинафталином, при которой появляется светло-бурая окраска, переходящая в зелено-желтую. ДИХЛОРЭТАН Известны два изомера дихлорэтана (С 2 Н 4 Сl 2): 1,1-дихлорэтан и 1,2-дихлорэтан. 1,1-Дихлорэтан (хлористый этилиден) СН 3 СНСl 2 — бесцветная жидкость (плотность 1,189 при 10 °С), кипящая при 58 °С. 1,2-Дихлорэтан (хлористый этилен) Сl—СН 2 —СН 2 —Сl — жидкость (плотность 1,252 при 20 °С), кипящая при 83,7 °С. В промышленности 1,2-дихлорэтан более широко используется, чем 1,1-дихлорэтан. 1,2-Дихлорэтан слабо растворяется в воде, хорошо растворяется в большинстве органических растворителей. Он стоек к действию кислот и щелочей. Воспламеняется с трудом. Технический 1,2-дихлорэтан содержит примесь трихлорэтилена С1—СН = СС1 2. Выделение дихлорэтана из биологического материала. Выделение дихлорэтана из биологического материала производится путем перегонки с водяным паром. На исследование берут первые порции дистиллята. В тех случаях, когда имеются специальные указания провести исследование биологического материала на наличие 1,2-дихлорэтана, получают около 300 мл дистиллята, который подвергают повторной перегонке и собирают первые 200 мл дистиллята. Этот дистиллят дважды подвергают перегонке с дефлегматором. Последний дистиллят (объемом 10 мл), полученный при отгонке жидкости с дефлегматором, подвергают исследованию на наличие 1,2-дихлорэтана. Обнаружение 1, 2-дихлорэтана Реакция Фудживара. При нагревании 1,2-дихлорэтана с пиридином в присутствии щелочи появляется красная окраска. Выполнение этой реакции производится так, как указано выше. Реакция отщепления атомов хлора. При нагревании дихлорэтана со щелочью отщепляются атомы хлора, которые можно обнаружить при помощи реакции с нитратом серебра. Однако отщепление атомов хлора от молекул 1,2-дихлорэтана при нагревании с водным раствором щелочи происходит труднее, чем от молекул хлороформа, хлоралгидрата и др.
Реакция образования этиленгликоля и обнаружение его после переведения в формальдегид. Эта реакция основана на том, что при нагревании дихлорэтана с раствором карбоната натрия в запаянной ампуле образуется этиленгликоль (см. выше).
Формальдегид, который образуется при указанной реакции, определяют при помощи реакций с хромотроповой или фуксинсернистой кислотой. Реакция образования ацетиленида меди. При нагревании 1,2-дихлорэтана в запаянной ампуле с раствором гидроксида натрия образуется ацетилен, который при взаимодействии с солями меди (I) дает ацетиленид меди (ацетиленистую медь), имеющий розовую или вишнево-красную окраску:
Реакция с хинолином. Для обнаружения 1,2-дихлорэтана в технических жидкостях применяют реакцию с хинолином. При нагревании дихлорэтана с хинолином образуется цианиновый краситель:
Для отличия 1,2-дихлорэтана от хлороформа, хлоралгидрата и четыреххлористого углерода могут быть использованы изонитрильная реакция, реакции с резорцином и реактивом Фелинга. Этих реакций не дает 1,2-дихлорэтан. ФОРМАЛЬДЕГИД Формальдегид (альдегид муравьиной кислоты)—газ, хорошо растворимый в воде, обладающий острым специфическим запахом. Водный раствор, содержащий 36,5—37,5 % формальдегида, называется формалином. Формальдегид изолируют из биологического материала путем перегонки с водяным паром. Однако этим методом перегоняется только незначительная часть формальдегида. Считают, что формальдегид в водных растворах находится в виде гидрата (метиленгликоля), который трудно отгоняется с водяным паром: НСНО + НОН ---> СН 2 (ОН) 2. Формальдегид угнетает центральную нервную систему, в результате этого может произойти потеря сознания, появляются судороги. Под влиянием формальдегида развиваются дегенеративные поражения печени, почек, сердца и головного мозга. Формальдегид оказывает влияние на некоторые ферменты. 60—90 мл формалина являются смертельной дозой. Метаболизм. Метаболитами формальдегида являются метиловый спирт и муравьиная кислота, которые, в свою очередь, подвергаются дальнейшему метаболизму. Обнаружение формальдегида Реакция с хромотроповой кислотой. Хромотроповая кислота (1,8-диоксинафталин-3,6-дисульфокислота) с формальдегидом в присутствии серной кислоты дает фиолетовую окраску.
Реакция с фуксинсернистой кислотой. Фуксинсернистая кислота (реактив Шиффа) с формальдегидом дает синюю или сине-фиолетовую окраску.
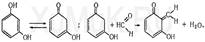
Реакция с метиловым фиолетовым. Метиловый фиолетовый, который аналогично фуксину предварительно обесцвечен сульфитом натрия, с формальдегидом дает сине-фиолетовую окраску. Реакция с кодеином и серной кислотой. При нагревании формальдегида с кодеином в присутствии концентрированной серной кислоты появляется синяя окраска. Эта реакция основана на том, что под влиянием концентрированной серной кислоты от кодеина отщепляется метоксильная группа, в результате чего образуется морфин, содержащий фенольную группу. При взаимодействии морфина с формальдегидом появляется синяя окраска. Реакция с резорцином. Альдегиды реагируют с резорцином в его таутомерной форме (кетоформе) с образованием окрашенного соединения:
Реакция восстановления ионов серебра. Из аммиачного раствора солей серебра формальдегид выделяет металлическое серебро:
Реакция с реактивом Фелинга. При нагревании реактива Фелинга с формальдегидом выпадает осадок оксида или гидроксида меди.
АЦЕТОН Ацетон СН 3 —СО—СН 3 (диметилкетон, пропанон) — бесцветная подвижная жидкость (т. кип. 56,3 °С) с характерным запахом. Он смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Из водных растворов ацетон высаливается хлоридом натрия, хлоридом кальция, карбонатом калия (жидкость разделяется на два слоя). После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови. Метаболизм. Незначительная часть ацетона, поступившего в организм, превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой. Обнаружение ацетона Реакция образования йодоформа. При взаимодействии ацетона с раствором иода в щелочной среде образуется йодоформ:
Реакция с нитропруссидом натрия. Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую:
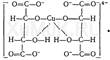
С нитропруссидом натрия окрашенные соединения образуют вещества, содержащие енолизируемые СО-группы
Кетоны, в молекулах которых отсутствуют метильные или метиленовые группы, связанные с СО-группами, не дают этой реакции. Реакция с фурфуролом. Эта реакция основывается на способности ацетона конденсироваться с фурфуролом и некоторыми другими альдегидами (ванилин, салициловый альдегид) с образованием окрашенных соединений:
Реакция с о -нитробензальдегидом. При взаимодействии ацетона с о-нитробензальдегидом в щелочной среде образуется индиго, имеющее синюю окраску:
Малые количества ацетона с о -нитробензальдегидом реагируют медленно. При этом сначала появляется желтая окраска, переходящая в желто-зеленую, а затем в зелено-синюю. Образовавшееся при этой реакции индиго хорошо экстрагируется хлороформом, который приобретает синюю окраску. ФЕНОЛ Фенол представляет собой тонкие длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол растворяется в воде в соотношении 1: 20, легко растворяется в этиловом спирте, диэти-ловом эфире, хлороформе, жирных маслах, растворах едких щелочей.
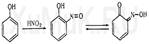
Метаболизм. Часть фенола в организме связывается с белками, а ча-сть — подвергается окислению с образованием гидрохинона и пирокатехина. Несвязанный фенол и его метаболиты (гидрохинон и пирокатехин) выделяются с мочой в виде конъюгатов с сульфатами и глюкуроновой кислотой. Выделение фенола из биологического материала. Фенол, содержащийся в трупном материале, выделяют путем перегонки с водяным паром, как и другие вещества этой группы ядов. В ряде случаев возникает необходимость производить обнаружение и количественное определение фенола в моче. В моче людей и животных, отравленных фенолом, он может находиться в несвязанном виде и в виде конъюгатов с сульфатами или глюкуроновой кислотой. Для изолирования несвязанного фенола из мочи ее подкисляют слабым раствором уксусной кислоты, а затем фенол отгоняют с водяным паром. Дистиллят, в который может переходить как фенол, так и часть уксусной кислоты, нейтрализуют гидрокарбонатом натрия, а затем из дистиллята фенол экстрагируют органическим растворителем. Полученную вытяжку используют для обнаружения и количественного определения фенола. Обнаружение фенола Реакция с бромной водой. От прибавления бромной воды к фенолу выпадает осадок трибромфенола:
Индофеноловая реакция. При окислении смеси фенолов и аминов (в том числе и аммиака) образуются индофенолы, имеющие соответствующую окраску:
Реакция Либермана. Эта реакция также основана на образовании индофенола. В качестве реактивов на фенолы применяют нитрит натрия и серную кислоту
При взаимодействии хиноидоксима с избытком фенола образуется индофенол, имеющий синюю окраску:
Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к фенолу появляется окраска. Реакция с реактивом Миллона. При взаимодействии фенола с реактивом Миллона (смесь нитратов одно- и двухвалентной ртути, содержащая азотистую кислоту) появляется красная или оранжевая окраска.
1,2-хинонмоноксим с ионами ртути образует окрашенное внутрикомплексное соединение:
Реакция с бензальдегидом. При нагревании фенолов в кислой среде с бензальдегидом (как и с рядом других альдегидов) образуется бесцветный продукт конденсации, при окислении которого возникает окраска. Концентрированная серная кислота при этой реакции играет роль дегидратирующего и конденсирующего вещества, а также роль окислителя. Метод микродиффузии. Этот метод, основанный на реакции с реактивом Фолина — Чиокальто, применяется для обнаружения фенола в моче, крови и гомогенатах тканей. Подробно этот метод описан выше (см. гл. III, § 3). КРЕЗОЛЫ Крезолы НО—С 6 Н 4 —СН 3 (метилфенолы, метилоксибензолы) являются производными фенола, в котором один атом водорода замещен метильной группой. В зависимости от положения метильной группы по отношению к фенольной группе крезолы подразделяются на о -крезол, м -крезол и n -крезол. о -Крезрл — кристаллы, имеющие характерный запах (т. пл. 30,9 °С), труднорастворимый в воде, легкорастворимый в этиловом спирте, ацетоне, бензине, бензоле, хлороформе, в растворах едких щелочей. Он не растворяется в растворах карбонатов щелочных металлов и в аммиаке. м -Крезол — жидкость (т. пл. 10,9 °С). м -Крезол растворяется в различных растворителях так же, как и о -крезол. n -Крезол — призматические кристаллы (т. пл. 34 °С), которые растворяются почти так же, как и о -крезол. Метаболизм. Небольшое количество крезолов в организме подвергается окислению. Из о- и м -крезолов образуются диокситолуолы, а п -крезол превращается в 3, 4-диокситолуол и п -оксибензойную кислоту. Как несвязанные крезолы, так и указанные выше метаболиты выделяются из организма почками в виде конъюгатов с сульфатами и глюкуроновой кислотой. Незначительное количество крезолов, поступивших в организм, выделяется в несвязанном виде с выдыхаемым воздухом. Обнаружение крезолов о -Крезол можно обнаружить при помощи реакции Либермана, индофеноловой реакции, реакций с хлоридом железа (III), бензальдегидом и реактивом Миллона. Для отличия о -крезола от м- и п -крезолов применяют реакции с бензальдегидом и хлоридом железа (III). Реакцию с бензальдегидом дает только о -кре-зол. Другие крезолы не дают этой реакции. При взаимодействии о-крезола с хлоридом железа (III) возникает синяя окраска, а м -крезол с этим реактивом дает красно-фиолетовую окраску. м -Крезол, как и о -крезол, дает индофеноловую реакцию, реакцию Либермана, реакции с хлоридом железа (III) и реактивом Миллона. Однако м -крезол не дает реакции с бензальдегидом. При взаимодействии м -крезола с хлоридом железа (III) возникает красно-фиолетовая окраска. Другие крезолы с этим реактивом дают синюю окраску. п -Крезол дает окраску с хлоридом железа и реактивом Миллона. Этот крезол не дает окраски с бензальдегидом, а также не дает индофеноловой реакции и реакции Либермана.
НИТРОБЕНЗОЛ Нитробензол — бесцветная жидкость (технический нитробензол окрашен в желтый цвет) с температурой кипения 211°. Обладает запахом горького миндаля. Качественное обнаружение нитробензола. Дистиллят осторожно извлекают небольшими порциями (по 5—10 мл) эфира. Объединенные эфирные извлечения фильтруют через сухой фильтр, испаряют и нитробензол обнаруживают после переведения его в динитробензол или в анилин. Переведение нитробензола в динитробензол производится путем обработки остатка по удалении эфира нитрующей смесью[10% раствор сухого (NH4)2S04 в H2S04 уд. в. 1,84] в течение 2 часов. Образовавшийся 1,3-динитробензол извлекают эфиром, предварительно разбавив в 5 раз реакционную жидкость водой инейтрализовав ее водным аммиаком. После удаления эфира остаток растворяют в возможно небольшом количестве ацетона (несколько капель) и смешивают с 2—4 каплями раствора едкого кали (или натра) в метиловом спирте—при наличии динитробензола возникает фиолетовое окрашивание. Обнаруживается 0,5 мг C6H5N02 в дистилляте (А, А Васильева). Вероятный химизм реакции: Восстановление нитробензола в анилин водородом в момент выделения Zn + 2НС1 = ZnCI2 + 2Н Образовавшийся анилин извлекают эфиром и исследуют реакциями на анилин (см. Анилин). Обнаруживается 0,4 мг нитробензола во всем объеме дистиллята. АНИЛИН Анилин — маслянистая жидкость, почти бесцветная в чистом состоянии, но быстро темнеющая в результате окисления поя влиянием кислорода воздуха на свету Удельный вес 1,025 Температура кипения 184° В воде при температуре 20° растворяется 3,4% анилина Анилин легко растворим в спирте, эфире, ацетоне, сероуглероде, жирах Водные растворы анилина обнаруживают очень слабую щелочную реакцию. Качественное обнаружение (после предварительного извлечения из дистиллята эфиром). 1. Часть дистиллята смешивают с растворами H2S04 и бихромата калия — постепенно наступает почернение вследствие образования анилинового черного — сложной смеси продуктов окисления анилина. Обнаруживается 50 мкг анилина в пробе (А. А. Васильева). 2. Часть дистиллята смешивают с насыщенным раствором брома в воде — белый осадок триброманилина 3. При взаимодействии с хлорамином и фенолом анилин и его производные образуют индофенол, щелочная соль которого окрашена в синий цвет 4. Реакция образования азокрасителя также может быть использована для обнаружения анилина и его производных. Количественное определение анилина основано либо на переведении его в триброманилин (весовое или объемное определение) либо на переведении в азокраситель (колориметрическое или фотоэлектроколориметрическое определение)
УКСУСНАЯ КИСЛОТА Безводная (ледяная) уксусная кислота СН 3 СООН представляет собой бесцветную гигроскопическую жидкость или бесцветные кристаллы с резким запахом. Она смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Метаболизм. Метаболитом уксусной кислоты является ацетальдегид, превращающийся частично в этиловый спирт и частично разлагающийся с образованием оксида углерода (IV) и воды. Уксусная кислота относится к веществам, изолируемым из объектов перегонкой с водяным паром. В отличие от других веществ этой группы уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 %-м раствором серной или фосфорной кислоты. Перегонку уксусной кислоты производят до отрицательной реакции дистиллята на наличие этой кислоты. Ввиду ее летучести дистиллят собирают в сосуд, содержащий 0,1 н. раствор гидроксида натрия. В дистилляте ацетат-ионы определяют при помощи перечисленных ниже реакций.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 3981; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.91.59 (0.008 с.) |