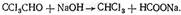Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обнаружение изоамилового спиртаСодержание книги
Поиск на нашем сайте
Для изолирования изоамилового спирта из объектов биологического происхождения применяют метод перегонки с водяным паром. Исследование дистиллятов на наличие изоамилового спирта производят для решения вопроса об отравлении самогоном, спиртом-сырцом или другими суррогатами этилового спирта. Реакция с салициловым альдегидом. Изоамиловый спирт с салициловым альдегидом в присутствии концентрированной серной кислоты дает окраску (реакция Комаровского). По одним данным, при этой реакции концентрированная серная кислота отнимает воду от изоамилового спирта, в результате чего образуется изоамилен (СН 3) 2 —СН—СН=СН 2, который взаимодействует с салициловым альдегидом. Согласно другим данным, концентрированная серная кислота окисляет изоамиловый спирт. Образовавшийся при этом альдегид изовалериановой кислоты вступает в реакцию конденсации с салициловым альдегидом. Реакция с n -диметиламинобензальдегидом. Изоамиловый спирт с n -диметиламинобензальдегидом в присутствии концентрированной серной кислоты дает окраску (реакция Комаровского). Реакция образования изоамилацетата. Эта реакция основана на том, что при взаимодействии ацетата натрия с изоамиловым спиртом в присутствии концентрированной серной кислоты образуется изоамилацетат, имеющий запах грушевой эссенции:
Реакция окисления изоамилового спирта. Изоамиловый спирт под влиянием перманганата калия в присутствии концентрированной серной кислоты окисляется до альдегида изовалериановой кислоты (СН 3) 2 —СН—СН 2 —СНО, а затем до изовалериановой кислоты (СН 3) 2 —СН—СН 2 —СООН. ЭТИЛЕНГЛИКОЛЬ Этиленгликоль (НО—СН 2 —СН 2 —ОН) является одним из представителей двухатомных спиртов, имеющих токсикологическое значение. Это бесцветная маслянистая жидкость (т. кип. 197 °С) сладковатого вкуса. Этиленгликоль смешивается с водой во всех соотношениях, плохо растворяется в диэтиловом эфире, хорошо—в этиловом спирте. Этиленгликоль перегоняется с водяным паром. Метаболизм. Метаболизм этиленгликоля является сложным. Основной путь метаболизма этого препарата состоит в том, что он окисляется до альдегида гликолевой кислоты НО—СН 2 —СНО, который дальше окисляется до гликолевой кислоты НО—СН 2 — СООН, разлагающейся на оксид углерода (IV) и муравьиную кислоту. Часть этиленгликоля в организме превращается в щавелевую кислоту, которая может быть причиной повреждения почек в результате отложения оксалатов в почечных канальцах. Оксид углерода (IV), как метаболит этиленгликоля, выделяется из организма с выдыхаемым воздухом. Остальные метаболиты и часть неизмененного этиленгликоля выделяется из организма с мочой. Выделение этиленгликоля из биологического материала. Метод выделения этиленгликоля из объектов химико-токсикологического анализа предложен Н. Б. Лапкиной и В. А. Назаренко. Этот метод основан на использовании бензола как селективного переносчика этиленгликоля из объектов в дистиллят. Бензол совместно с парами этиленгликоля и небольшим количеством водяного пара переносится в дистиллят. Вода, которая перегоняется при этом, практически содержит весь этиленгликоль. На исследование берут печень трупа, в которой после отравления содержится больше этиленгликоля, чем в других органах. При острых отравлениях этиленгликолем исследованию подвергают и желудок с содержимым. К 10 г печени или содержимого желудка прибавляют 5 г кристаллической щавелевой кислоты, смесь растирают до получения тонкой кашицы, переносят в круглодонную колбу 1 вместимостью 100 мл и прибавляют 50 мл бензола. Колбу закрывают вертикально поставленным холодильником 3, снабженным приспособлением 2 для улавливания воды. Затем колбу устанавливают на водяную баню и нагревают. Пары бензола и увлекаемые им вода и этиленгликоль конденсируются в холодильнике и попадают в специальное приспособление. Поскольку в этом приспособлении (насадке) бензол (плотностью 0,879) находится сверху воды, он стекает в колбу. Вода и находящийся в ней этиленгликоль остаются в насадке. После окончания отгонки разбирают прибор и пипеткой из насадки отбирают необходимое для анализа количество жидкости. Обнаружение этиленгликоля. Реакция окисления этиленгликоля периодатом и обнаружение образовавшегося формальдегида. В результате указанной реакции образуется формальдегид, который можно обнаружить при помощи фуксинсернистой кислоты:
Окисление этиленгликоля азотной кислотой и обнаружение щавелевой кислоты. При многократном выпаривании этиленгликоля с азотной кислотой образуется щавелевая кислота, которая с солями кальция образует кристаллы оксалата кальция, имеющие характерную форму. Эти кристаллы в ряде случаев появляются через 2—3 суток. Реакция с сульфатом меди. От прибавления сульфата меди и щелочи к этиленгликолю образуется соединение, имеющее синюю окраску:
ХЛОРОФОРМ Хлороформ (трихлорметан) СНCl 3 — бесцветная прозрачная летучая жидкость с характерным запахом. Смешивается с диэтиловым эфиром, этиловым спиртом и другими органическими растворителями, слабо растворяется в воде (см. табл. 1). Под влиянием света, воздуха, влаги и температуры хлороформ постепенно разлагается. При этом могут образовываться фосген, муравьиная и соляная кислоты. Метаболизм. Хлороформ, поступивший в организм, быстро исчезает из крови. Через 15—20 мин с выдыхаемым воздухом в неизмененном виде выделяется 30—50 % хлороформа. В течение часа через легкие выделяется до 90 % хлороформа, поступившего в организм. Однако еще и через 8 ч в крови можно обнаружить незначительные количества хлороформа. Часть хлороформа подвергается биотрансформации. При этом в качестве метаболитов образуются оксид углерода (IV) и хлороводород. При химико-токсикологических исследованиях основными объектами анализа на наличие хлороформа в организме являются выдыхаемый воздух, богатые жирами ткани трупов и печень. Обнаружение хлороформа Реакция отщепления хлора. При нагревании хлороформа со спиртовым раствором щелочи происходит отщепление атомов хлора, которые можно обнаружить при помощи реакции с нитратом серебра:
Перед выполнением этой реакции необходимо убедиться в том, что в исследуемом растворе (дистилляте) и в реактивах отсутствуют ионы хлора. Реакция Фудживара. Хлороформ и ряд других галогенсодержащих соединений можно обнаружить при помощи реакции Фудживара, которая основана на взаимодействии этих веществ с пиридином в присутствии щелочи. При взаимодействии хлороформа с пиридином и щелочью образуется полиметиновый краситель. При этой реакции вначале образуется соль пиридиния:
Под влиянием щелочи соль пиридиния превращается в производное глутаконового альдегида (I), при гидролизе которого образуется глутаконовый альдегид (II), имеющий окраску:
Описано два варианта реакции Фудживара. При использовании первого варианта наблюдают окраску образовавшегося глутаконового альдегида. При втором варианте этой реакции к образовавшемуся глутаконовому альдегиду прибавляют ароматический амин или другое соединение, содержащее подвижный атом водорода, а затем наблюдают окраску. Реакция с резорцином. При нагревании хлороформа с резорцином в присутствии щелочи появляется розовая или малиново-красная окраска. Реакция образования изонитрила. При нагревании хлороформа с первичными аминами и щелочью образуется изонитрил (карбиламин), имеющий неприятный запах:
Реакция с реактивом Фелинга. При взаимодействии хлорофор ма со щелочью образуется соль муравьиной (формиатной) кислоты:
Реактив Фелинга, содержащий внутрикомплексное соединение K 2 Na 2 [Cu(С 4 Н 3 O 6) 2 ], которое образуется при взаимодействии ионов меди (II) с сегнетовой солью, при нагревании окисляет муравьиную кислоту и ее соли. В результате реакции выпадает красного цвета осадок оксида меди (I):
ХЛОРАЛГИДРАТ Хлоралгидрат — бесцветные кристаллы или мелкокристаллический порошок с характерным острым запахом и слегка горьковатый, растворяется в воде, этиловом спирте, диэтиловом эфире и хлороформе. Хлоралгидрат гигроскопичен и медленно улетучивается на воздухе. Метаболизм. Хлоралгидрат быстро всасывается в кровь из пищевого канала. В организме он подвергается метаболизму. Метаболитами хлоралгидрата являются трихлорэтанол и трихлоруксусная кислота. Считают, что токсическое действие хлоралгидрата на организм объясняется образованием трихлорэтанола. Трихлоруксусная кислота в организме может образовываться двумя путями: непосредственно из хлоралгидрата и из трихлорэтанола. Трихлорэтанол из организма выделяется с мочой в виде глюкуронида. После смерти, наступившей в результате отравления хлоралгидратом, определенное количество его в неизмененном виде можно обнаружить в печени и желудке. Обнаружение хлоралгидрата Хлоралгидрат дает все реакции, которые в химико-токсикологическом анализе применяются для обнаружения хлороформа. Это объясняется тем, что применяемые в химико-токсикологическом анализе реакции на хлороформ производятся в присутствии щелочи, под влиянием которой хлоралгидрат разлагается с выделением хлороформа:
Для отличия хлоралгидрата от хлороформа может быть использована реакция с реактивом Несслера. Эту реакцию дает хлоралгидрат, содержащий альдегидную группу. Не дает этой реакции хлороформ. Реакция с реактивом Несслера. При взаимодействии хлоралгидрата с реактивом Несслера выделяется свободная ртуть:
ЧЕТЫРЕХХЛОРИСТЫЙ УГЛЕРОД Четыреххлористый углерод ССl 4 — прозрачная жидкость со своеобразным запахом (т. кип. 75—77 °С). Он смешивается в любых соотношениях с ацетоном, бензолом, бензином, сероуглеродом и другими органическими растворителями. В воде при 20 °С растворяется около 0,01 % четыреххлористого углерода. Четыреххлористый углерод не огнеопасен, его пары в несколько раз тяжелее воздуха. Четыреххлористый углерод поступает в организм при вдыхании его паров, а также может поступать через неповрежденную кожу и пищевой канал. Четыреххлористый углерод неравномерно распределяется в организме. Количество его в ткани, богатой жирами, в несколько раз больше, чем в крови. Содержание четыреххлористого углерода в печени и в костном мозгу значительно выше, чем в легких. В эритроцитах крови трупов содержится четыреххлористого углерода примерно в 2,5 раза больше, чем в плазме. Метаболизм. Четыреххлористый углерод быстро выделяется из организма. Уже через 48 ч после поступления в организм его нельзя обнаружить в выдыхаемом воздухе. Его метаболитами являются хлороформ и оксид углерода (IV).
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 3764; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.011 с.) |

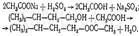








 или
или