
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергию Гиббса при соответствующих температурах находим из соотношенияСодержание книги
Поиск на нашем сайте
DG0х.р. =DH0х.р – ТDS0х.р.; DG0298 = 490,7 – 298 × 0,540 = +329,8 кДж; DG01000 = 490,7 – 1000 × 0,540 = –49,3 кДж. Так как DG0298 > 0, а DG01000 < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 298 К.
Задачи 3.1. а) Вычислить тепловой эффект и написать термохимическое уравнение реакции между СО (г) и Н2 (г), в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится, если в реакции было израсходовано 100 л СО (условия нормальные)? (Ответ: -206,2 кДж; 920,5 кДж). б) Прямая или обратная реакция будет протекать при 298 К в системе 2NO (г) + O2 (г) = 2NO2 (г)? Ответ обосновать, вычислив ∆G0х.р. 3.2. а) Реакция горения этилена выражается уравнением С2Н4 (г) + 3О2 (г) = 2СО2 (г) + 2Н2О (г). При сгорании 1 л С2Н4 (н.у.) выделяется 59,06 кДж теплоты. Определить стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль). б) Пользуясь значениями С(графит) + О2 (г) = СО2 (г), (Ответ: −394,4 кДж). 3.3. а) Сожжены с образованием H2O (г) равные объемы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ: 5,2). б) Исходя из стандартных энтальпий образования и стандартных энтропий соответствующих веществ, вычислить ∆G0х.р. Н2 (г) + СО2 (г) = СО (г) + Н2О (ж). Может ли эта реакция при стандартных условиях идти самопроизвольно? (Ответ: 20 кДж). 3.4. а) Вычислить, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена, если продуктами сгорания являются диоксид углерода и пары воды. (Ответ: 9248,8 кДж). б) Возможна ли при стандартных условиях реакция 4Al (к) + 3CO2 (г) = 2Al2O3 (к) + 3C (к) Ответ обосновать, вычислив ∆G0х.р. 3.5. а) Газообразный этиловый спирт С2H5OH можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Вычислить тепловой эффект этой реакции и написать термохимическое уравнение. Сколько теплоты выделится, если в реакции было израсходовано 100 л этилена (н.у.)? (Ответ: -45,8 кДж; 204,5 кДж). б) Вычислить изменение энтропии реакции С2Н4 (г) + 3О2 (г) = 2СО2 (г) + 2Н2О (г). (Ответ: −29,6 Дж/К). 3.6. а) Вычислить, какое количество теплоты выделилось при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. (Ответ: 2554,5 кДж). б) Рассчитать ∆G0 реакции N2 (г) + 2H2O (ж) = NH4NO2 (к) и сделать вывод о возможности ее протекания.
(Ответ: 590,5 кДж). 3.7. а) При растворении 16 г СаС2 в воде выделяется 31,27 кДж теплоты. Определить стандартную энтальпию образования Са(ОН)2. (Ответ: –986,2 кДж/ моль). б) Вычислить DS0 следующих реакций: С(графит) + СО2 (г) = 2СО (г); С(графит) + О2 (г) = СО2 (г) (Ответ: 175,6 Дж/К; 3 Дж/К). 3.8. а) При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 8,24 кДж. Определить стандартную энтальпию образования СuO. (Ответ: –162 кДж/моль). б) Вычислить, при какой температуре наступит равновесие системы СО (г) + 2Н2 (г) ↔ СН3ОН (ж). (Ответ: 386 К). 3.9. а) Вычислить тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO (к) + CO (г) = Fe (к) + СO2 (г), ∆Н0(1) = –19,2 кДж;(1) СO (г) + ½O2 (г) = СO2 (г), ∆Н0(2)= –283 кДж;(2) H2 (г) + ½O2 (г) = H2O (г), ∆Н0(3)= –241,8 кДж.(3) (Ответ: 22 кДж). б) Реакция горения ацетилена идет по уравнению С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (ж). Вычислить ∆G0х.р. и ∆S0х.р. Объяснить уменьшение энтропии в результате этой реакции. (Ответ: −1235,3 кДж; −215,8 Дж/К). 3.10. а) Вычислить стандартную энтальпию образования NO из простых веществ, исходя из следующих термохимических уравнений: 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2О (ж), ∆Н0(1)= –1168,80 кДж; (1) 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж), ∆Н0(2) = –1530,28 кДж. (2) (Ответ: 90,37 кДж). б) При какой температуре наступит равновесие системы СН4 (г) + СО2 (г) = 2СО (г) + 2Н2 (г), ∆Н0х.р. = +247,4 кДж. (Ответ: 965,2 К). 3.11. а) Восстановление диоксида свинца водородом протекает по уравнению PbO2 (к) + H2 (г) = PbO (к) + H2O (г), ∆Н0х.р. = −182,5 кДж. Вычислить стандартную энтальпию образования PbO2. (Ответ: −276,6 кДж/моль). б) Вычислить, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению PCl5 (г) = PCl3 (г) + Cl2 (г), ∆Н0х.р. = +92,4 кДж.
3.12. а) Исходя из уравнения реакции горения ацетилена С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г), DH0х.р. = –1255,6 кДж, вычислить, сколько теплоты выделится при сгорании 1 м3 С2Н2 (н.у.). (Ответ: 56053,5 кДж). б) Какой из карбонатов ВеСО3, или СаСО3 можно получить по реакции взаимодействия соответствующих оксидов с СО2? Вывод сделать, вычислив ∆G0х.р.. (Ответ: +31,4 кДж; -129,9 кДж). 3.13. а) Определить количество теплоты, выделившейся при взаимодействии 50 г фосфорного ангидрида с водой по реакции
Р2О5 (к) + H2O (ж) = 2HPO3 (ж), если тепловые эффекты реакции равны: 2Р (к) + 5½O2 (г) = Р2О5 (к), ∆Н0 = –1492 кДж; 2Р (к) + H2 (г) + 3O2 (г) = 2HPO3 (ж), ∆Н0 = –1964,8 кДж. (Ответ: 65,8 кДж). б) Рассчитать стандартную энтропию оксида железа (III), если известно изменение энтропии реакции 4FeO (к) + O2 (г) = 2Fe2O3 (к), ∆S0х.р.= –260,4 Дж/К. (Ответ: 89,9 Дж/моль К). 3.14. а) Определить тепловой эффект реакции, протекающей по уравнению: PbO2 (к) + СО (г) = PbO (к) + СO2 (г). (Ответ: −223,7 кДж). б) Вычислить ∆Н0х.р., ∆S0х.р. и ∆G0Т реакции, протекающей по уравнению Fe2O3 (к) + 3Н2 (г) = 2Fe (к) + 3Н2O (г). Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 1500 К? (Ответ: +96,8 кДж; 138,8 Дж/К; 27,3 кДж; –111,7 кДж). 3.15. а) Определить стандартную энтальпию образования пентахлорида фосфора РСl5 из простых веществ, исходя из следующих термохимических уравнений: 2Р + 3Сl2 = 2РСl3, ∆Н0(1)= –554,0 кДж; (1) РСl3 + Сl2 = РСl5, ∆Н0(2) = –92,4 кДж. (2) (Ответ: –369,2 кДж/моль). б) При какой температуре наступит равновесие системы 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г), DH0х.р. = –114,4 кДж.
3.16. а ) Выислить тепловой эффект и написать термохимическое уравнение реакции между СН4 (г) и Н2О (г), в результате которой образуются СО (г) и Н2 (г). (Ответ: 206,2 кДж). б) Рассчитать энергию Гиббса химических реакций, протекающих по уравнениям: CaO (к) + Н2О (г) = Са(ОН)2 (к); (1) Р2О5 (к) + 3Н2О (г) = 2Н3РО4 (к), (2) и определить, какой из двух оксидов, CaO или Р2О5 при стандартных условиях лучше поглощает водяные пары. (Ответ: –65,5 кДж; –205,2кДж). 3.17. а) Определить стандартную энтальпию образования фосфина РН3, исходя из уравнения: 2РН3 (г) + 4О2 (г) = Р2О5 (к) + 3Н2О (ж), DH0х.р. = –2360 кДж. (Ответ: 5,3 кДж/моль). б) Вычислить значения ∆G0х.р. следующих реакций восстановления оксида железа (III): Fe2O3 (к) + 3Н2 (г) = 2Fe (к) + 3Н2О (г); (1) 2Fe2O3 (к) + 3С (к) = 4Fe (к) + 3СО2 (г); (2) Fe2O3 (к) + 3СO (г) = 2Fe (к) + 3СО2 (г). (3). Протекание какой из этих реакций наиболее вероятно? (Ответ: +55 кДж; +298,4 кДж; –31,1 кДж). 3.18. а) При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Рассчитать тепловой эффект и написать термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислить энтальпию образования С2Н5ОН (ж). (Ответ: −1234,8 кДж; –277,6 кДж/моль.). б) Пользуясь значениями ∆Н0х.р., ∆S0х.р.,вычислить∆G0реакции, протекающей по уравнению PbO2 + Pb = 2PbO. Определить, возможна ли эта реакция при 298 К.(Ответ: –157,3 кДж.). 3.19. а) При сгорании 9,3 г фосфора выделяется 223,8 кДж теплоты. Рассчитать энтальпию образования оксида фосфора (V). (Ответ: –1492 кДж.). б) Какой из двух процессов разложения нитрата аммония наиболее вероятен при 298 К? NH4NO3 (к) → N2O (г) + 2H2O (г); (1) NH4NO3 (к) → N2 (г) + ½O2 (г) + 2H2O (г). (2) Ответ обосновать, рассчитав ∆G0х.р.(Ответ: –169,1 кДж; –273,3 кДж.). 3.20. а) Реакция горения метана протекает по уравнению СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г). Рассчитать тепловой эффект реакции и количество теплоты, которое выделится при сгорании 100 л метана (н.у.). (Ответ: –802,2 кДж; 3581,3 кДж). б) Вычислить стандартную энергию Гиббса образования NH3, исходя из значений энтальпии образования NH3 и изменения энтропии (∆S0) реакции N2 (г) + 3Н2 (г) = 2NH3 (г). (Ответ: – 16,7кДж/моль). Лабораторная работа 4 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Цель работы: изучить понятие «скорость реакции», зависимость скорости реакции от концентрации (закон действия масс) и температуры (правило Вант-Гоффа).
Задание: провести реакцию между тиосульфатом натрия и серной кислотой и установить зависимость скорости реакции от концентрации и температуры. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции, за единицу времени. Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. В общем случае для реакции nA + mB = pАВ зависимость скорости реакции от концентрации выражается уравнением:
где k – константа скорости реакции; CА и CВ – концентрации реагирующих веществ; n и m – коэффициенты перед веществами А и В. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: в гомогенной системе при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза:
Выполнение работы
Зависимость скорости реакции от концентрации реагирующих веществ и температуры удобно исследовать на примере взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3 + H2SO4 = Na2SO4 + SO2+ S↓ + H2O Признаком окончания реакции является помутнение раствора вследствие выделения серы. Время, которое проходит от начала реакции до заметного появления мути, позволяет судить об относительной скорости реакции.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.47.194 (0.011 с.) |

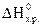 и
и  , вычислить ∆G0 реакции при 298 К
, вычислить ∆G0 реакции при 298 К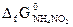 = 115,9 кДж/моль.
= 115,9 кДж/моль.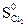 = 223 Дж/моль ∙ К. (Ответ: 448,6 К).
= 223 Дж/моль ∙ К. (Ответ: 448,6 К). = -944,8 кДж/моль;
= -944,8 кДж/моль;  = -581,6 кДж/моль.
= -581,6 кДж/моль.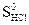 = 186,7 Дж/моль ∙ К. (Ответ: 891 К).
= 186,7 Дж/моль ∙ К. (Ответ: 891 К). ,
,
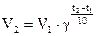 , где V2и V1 – скорость реакции при температурах t2 и t1; γ – температурный коэффициент скорости реакции.
, где V2и V1 – скорость реакции при температурах t2 и t1; γ – температурный коэффициент скорости реакции.


