
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В зависимости от концентрации ионов водорода различают три среды.Содержание книги
Поиск на нашем сайте
В нейтральной среде [H+] = [OH-]= 10-7 моль/л, рН= – lg 10-7 = 7. Эта среда характерна как для чистой воды, так и для нейтральных растворов. В кислых растворах [H+] > 10-7моль/л, рН < 7. В кислых средах рН меняется в пределах 0 < рН < 7. В щелочных средах [H+] < [ОН–] и [H+] < 10-7 моль/л, следовательно, рН > 7. Пределы изменения рН: 7 < рН < 14. Реакции ионного обмена (РИО) – это реакции между ионами, протекающие в водных растворах электролитов. Отличительная особенность обменных реакций: элементы, входящие в состав реагирующих веществ, не меняют свою степень окисления. Реакции ионного обмена являются необратимыми реакциями и протекают при условии: 1) образования малорастворимого вещества, 2) выделения газообразного вещества, 3) образования слабого электролита. При протекании РИО противоположно заряженные ионы связываются и выводятся из сферы реакции. Сущность реакций ионного обмена выражают с помощью ионных уравнений, которые, в отличие от молекулярных, показывают истинных участников реакции. При составлении ионных уравнений следует руководствоваться тем, что вещества малодиссоциирующие, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Сильные растворимые электролиты записываются в виде ионов. Поэтому при написании ионных уравнений необходимо пользоваться таблицей растворимости солей и оснований в воде. Гидролиз – это процесс взаимодействия ионов соли с молекулами воды, приводящий к образованию малодиссоциирующих соединений; является частным случаем реакций ионного обмена. Гидролизу подвергаются соли, образованные: 1) слабой кислотой и сильным основанием (NaCH3COO, Na2CO3, Na2S,); 2) слабым основанием и сильной кислотой (NH4Cl, FeCl3,, AlCl3,); 3) слабым основанием и слабой кислотой (NH4CN, NH4CH3COO). Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются: Na2SO4, BaCl2, NaCl, NaJ и т.д. Гидролиз солей увеличивает концентрации ионов Н+ или ОН–. Это приводит к смещению ионного равновесия воды и в зависимости от природы соли сообщает раствору кислую или щелочную среду (см. примеры решения задач). Примеры решения задач Пример 1. Вычислить константу диссоциации уксусной кислоты СН3СООН, зная, что в 0,1М растворе она диссоциирована на 1,32%. Р е ш е н и е. Для решения задачи воспользуемся законом разбавления Оствальда – уравнение (13), в котором С – концентрация уксусной кислоты, a – степень ее диссоциации в данном растворе, значение которой равно 1,32/100=0,0132. Таким образом, Ответ: константа диссоциации уксусной кислоты составляет 1,76×10-5. Пример 2. Вычислить значение рН 0,1М раствора гидроксида аммония NH4OH, приняв степень диссоциации раствора равной 1%. Р е ш е н и е. 1) Записываем уравнение диссоциации раствора NH4OH: NH 4OH ⇄ NH4+ + OH– 2) Так как гидроксид аммония – слабый электролит и процесс его диссоциации носит обратимый характер, к моменту равновесия в 1 л раствора продиссоциировало С∙a моль NH4OH (С = 0,1 моль/л) и образовалось столько же моль ОН– – ионов: 3) Рассчитываем значение рН: pH + pOH = 14, рН = 14 – 3 = 11. Ответ: рН 0,1М раствора гидроксида аммония равно 11. Пример 3. Выразить с помощью ионного уравнения сущность реакции: Pb(NO3)2 + KI ® Р е ш е н и е. 1) Составляем молекулярное уравнение реакции: Pb(NO3)2 + 2KI ® PbI2¯ + 2KNO3 Отмечаем, что в результате образуется нерастворимое вещество PbI2. 2) Составляем полное ионное уравнение (все сильные электролиты записываем в виде ионов, слабые, уходящие из сферы реакции, – в виде молекул): Pb2+ + 2NO3– + 2K+ + 2I– = PbI2¯ + 2K+ + 2NO3– 3) Составляем сокращенное ионное уравнение, в котором исключаем все ионы, повторяющиеся в обоих частях уравнения, т.е. ионы не участвующие в реакции: Pb2+ + 2NO3 – + 2K+ + 2I– = PbI2¯ + 2K+ + 2NO3 – Pb2++ 2I– = PbI2¯ Из сокращенного ионного уравнения видно, что сущность реакции сводится к взаимодействию ионов Pb2+ и I–, в результате которого образуется труднорастворимое вещество PbI2. Пример 4. Определить характер среды водного раствора соли ZnCl2. Р е ш е н и е. ZnCl2 – соль образованная сильной кислотой HCl и слабым основанием Zn(OH)2, следовательно, подвергается гидролизу по катиону. Так как катион двухзарядный, гидролиз будет протекать по двум ступеням. I ступень: а) записываем уравнение процесса диссоциации ZnCl2: ZnCl2 = Zn2+ + 2Cl– Подчеркнем ион, по которому идет гидролиз, это ион Zn2+. б) процесс взаимодействия иона Zn2+ с водой происходит по схеме: Zn2+ + H+–OH– ⇄ (ZnOH)+ + H+ в) запишем суммарное уравнение гидролиза: ZnCl2 = Zn2+ + 2Cl–
ZnCl2 + Zn2+ + H2O ⇄ Zn2+ + (ZnOH)+ + 2Cl– + H+ После преобразований получаем: ZnCl2 + H2O ⇄ Zn(OH)Cl + HCl В результате гидролиза образуется сильная кислота HCl, поэтому рН < 7. II ступень: При рассмотрении гидролиза по второй ступени используется аналогичный подход. а) Zn(OH)Cl = (ZnOH)+ + Cl– б) (ZnOH)+ + H+–OH– = Zn(OH)2 + H+ в) Zn(OH)Cl = (ZnOH)+ + Cl–
Zn(OH)Cl + H2O = Zn(OH)2¯ + HCl Таким образом, в результате гидролиза по второй ступени образуется сильная кислота HCl, которая создает кислую среду раствора (рН < 7). 1. 8. Растворы. Способы выражения концентрации растворов Раствор – гомогенная (однородная) система, состоящая как минимум из двух компонентов, один из которых растворитель, другой – растворенное вещество. То есть состав раствора = растворитель + растворенное вещество. Например, водный раствор хлорида натрия состоит из двух компонентов: воды (растворителя) и хлорида натрия (растворенного вещества).
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 386; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.173.197 (0.006 с.) |

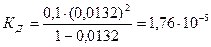
 Zn2+ + H2O ⇄ (ZnOH)+ + H+
Zn2+ + H2O ⇄ (ZnOH)+ + H+ (ZnOH)+ + H2O = Zn(OH)2 + H+
(ZnOH)+ + H2O = Zn(OH)2 + H+


