
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Существует несколько способов выражения концентрации растворов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Молярная концентрация, или молярность (СM)– количество вещества (ν) растворенного компонента, содержащееся в 1 литре (дм3) раствора:
Молярная концентрация эквивалентов (Сэкв), (нормальная концентрация или нормальность N) – количество вещества эквивалентов (ν экв) растворенного компонента, содержащееся в 1 литре (дм3) раствора: Сэкв ( N) = νэкв / V [моль-экв/л] (15) Моляльная концентрация или моляльность (b) – количество вещества (ν) растворенного компонента в 1 кг раствора:
Массовая доля (ω) – отношение массы растворенного вещества (mр.в .) к массе раствора (mр-ра) Ее рассчитывают, выражая в долях единицы или в процентах. Массовая доля, выраженная в процентах, называется процентной концентрацией:
Процентная концентрация показывает массу растворенного вещества, содержащегося в 100 г раствора. Например, ω( KOH) = 3% означает, что в 100 г этого раствора содержится 3 г KOH и 97 г H2O. Молярная доля (Ni) – отношение количества вещества растворенного компонента (nв-ва) (или растворителя, nр-ля) к суммарному количеству вещества всех компонентов раствора. Например, в системе, состоящей из растворителя и одного растворенного вещества, молярная доля растворенного вещества равна:
Молярная доля растворителя:
Примеры решения задач Пример 1. Определить молярную концентрацию раствора NaOH с массовой долей 10% и плотностью r =1,1 г/см3. Р е ш е н и е. 1) Записываем выражение для молярной концентрации раствора NaOH: 2) 10%-ный раствор – это 10г NaOH в 100г раствора. Находим количество вещества NaOH, содержащееся в 10 г:
3) Находим объем раствора массой 100 г: m =V×r, 4) Рассчитываем молярную концентрацию:
Ответ: молярная концентрация раствора гидроксида натрия с массовой долей 10% составляет 2,74 моль/л Пример 2. Найти молярную долю растворенного вещества в растворе сахарозы с массовой долей 67%. Р е ш е н и е. 1) Вспомним, что молярная доля растворенного вещества равна:
67%-ный (по массе) раствор означает, что в 100 г раствора содержится 67 г сахарозы и 33 г воды. 2) Определяем количество вещества сахарозы и количество вещества воды: nв-ва = 67/342 = 0,196 моль, nр-ля = 33/18 = 1,83 моль Следовательно, молярная доля сахарозы равна:
Ответ: молярная доля сахарозы в растворе сахарозы с массовой долей 67% составляет 0,097. Пример 3. Какой объем серной кислоты с массовой долей 96% (плотностью 1,84 г/см3) и какую массу воды нужно взять для приготовления 100 мл 15%-ного (по массе) раствора H2SO4 (r = 1,10 г/см3). Р е ш е н и е. 1) Найдем массу 100 мл 15% раствора H2SO4: mH2SO4-р-ра = V×r = 100×1,10 =110 г 2) Из формулы массовой доли находим массу серной кислоты, содержащейся в этом растворе:
3) Найдем массу 96% раствора, содержащего 16,5 г H2SO4:
4) Находим объем 96 %-ного раствора серной кислоты:
Ответ: для приготовления 100мл 15%-ного раствора H2SO4 потребуется 9,3 мл 96%-ного раствора серной кислоты и 110 – 16,5 = 93,5 г воды. Коллоидные растворы Дисперсные системы - это системы, состоящие как минимум из двух веществ, одно из которых измельчено и распределено в другом. То вещество, которое образует в дисперсной системе сплошную фазу, называют дисперсионной средой, а то, что распределено в среде – дисперсной фазой. Гомогенные дисперсные системы называют истинными растворами или просто растворами. Линейные размеры их частиц не превышают размеров отдельных ионов и молекул – до 1 нм. Гетерогенные дисперсные системы подразделяются на коллоидные системы (размеры частиц от 1 до 100 нм) и грубодисперсные или микрогетерогенные системы (размеры частиц более 100 нм). Коллоидные системы, дисперсионная среда которых жидкость, называются коллоидными растворами или золями. Их можно рассматривать как частный случай истинных растворов. Дисперсная фаза – это растворенное вещество, а дисперсионная среда – растворитель. Для получения коллоидных растворов используются любые реакции, в результате которых образуются труднорастворимые соединения: FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl (20) AgNO3 + KI = AgI↓ +KNO3 (21) Ba(Cl)2 + Na2SO4 = BaSO4↓+ 2NaCl (22) Структурной единицей коллоидного раствора является мицелла – это отдельная частица дисперсной фазы с жидкой дисперсионной средой. Рассмотрим образование мицеллы на примере реакции (21). Избыток одного из компонентов действует как стабилизатор коллоидного раствора, то есть как вещество, препятствующее агрегации коллоидных частиц в более крупные и выпадению их в осадок. Пусть в избытке будет азотнокислое серебро. Труднорастворимый AgI образует кристаллический агрегат, состоящий из m молекул AgI. Агрегат адсорбирует на поверхности ионы Ag+, находящиеся в избытке. Они придают агрегату положительный заряд и называются потенциалопределяющими ионами. Агрегат и потенциалопределяющие ионы образуют ядро (m AgI) n Ag+. С заряженной поверхностью ядра устойчиво связано некоторое число ионов противоположного знака – противоионов – (n-x ) NO3–. Потенциалопределяющие ионы и связанные противоионы образуют адсорбционный слой. Агрегат вместе с адсорбционным слоем называется гранулой или коллоидной частицей. Она имеет электрический заряд, совпадающий с зарядом потенциалопределяющего иона (х+). В состав коллоидной частицы входит только часть имеющихся в растворе противоионов. Остальные противоионы xNO3- остаются в дисперсионной среде и образуют диффузионный слой. Заряды потенциалопределяющих ионов и противоионов полностью скомпенсированы. Поэтому мицелла электронейтральна. Строение мицеллы золя иодида серебра имеет вид: ядро {[mAgI]nAg+(n-x)NO3-}x+ ∙ xNO3- агрегат адсорбционный диффузионный слой слой Если в растворе избыток KI, то мицелла будет иметь вид: {[mAgI]nI-(n-x)K+ }x- ∙ xK+ Строение мицеллы золя сульфата бария, полученного по реакции (22) с избытком хлорида бария: {[m BaSO4] n Ba2+ 2(n-x)Cl-}2x+ 2xCl- Строение мицеллы золя Fe(OH)3: {[m (FeOH)3] nFe3+ 3(n-x)Cl- }3x+ 3xCl- Устойчивость – способность коллоидных систем сохранять свое состояние и свойства неизменными с течением времени. Различают два вида устойчивости: кинетическую (седиментационную) и агрегативную. Кинетическая устойчивость характеризует способность частиц дисперсной фазы оставаться во взвешенном состоянии благодаря интенсивному броуновскому движению. Агрегативная устойчивость характеризует способность частиц дисперсной фазы противостоять их агрегации, т.е. укрупнению и слипанию. Это обусловлено наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц. Это можно сделать при добавлении электролита. Потеря агрегативной устойчивости золя приводит к укрупнению частиц дисперсной фазы, их слипанию Этот процесс называют коагуляцией. Коагуляция вызывает нарушение кинетической устойчивости, которое приводит к образованию осадка (коагулята). Этот процесс называется с едиментацией. Коагулирующим действием обладает тот ион, который заряжен противоположно частице. Коагулирующая способность электролита возрастает с увеличением заряда коагулирующего иона. Например, для золя иодида серебра коагулирущим действием будут обладать такие анионы, как Cl-, SO42-, PO43 -. Из них наилучшим коагулирующим действием обладает ион PO43-. Процесс коагуляции начинается только после достижения определенной минимальной концентрации электролита, которая называется порогом коагуляции. Примерный состав коагулята золей иодида серебра и гидроксида железа: {[mAgI]nAg+ nNO3-}0 , { [m (FeOH)3] nFe3+ 3nCl- }0
Примеры решения задач Пример 1. Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 М раствора KI 0,028 л 0,005М раствора AgNO3. Определите заряд частиц полученного золя и напишите формулу его мицеллы. Д а н о: С KI = 0,01 моль/л; С AgNO3 = 0,005 моль/л, V KI = 0,02 л; V AgNO3 = 0,028 л. Определить заряд полученного золя. Написать формулу мицеллы золя. Р е ш е н и е. При смешении растворов AgNO3 и KI протекает реакция: AgNO3 + KI = AgI + KNO3 Определяем количество AgNO3 и KI, участвующих в реакции: СVAgNO3 = 0,005×0,028 = 1,4×10-4 моль CVKI = 0,02×0,01 = 2,0×10-4 моль Расчет показывает, что в растворе избыток KI, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы I– и частицы золя приобретают отрицательный заряд. Противоионами являются ионы К+. Формула мицеллы золя иодида серебра при условии избытка KI: {[mAgI] nI– (n–x)K+}–x ×xK+ Пример 2. Какой объем 0,002 М раствора BaCl2 надо добавить к 0,03 л 0,0006 М раствора Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4. Д а н о: С BaCl2 = 0,002 моль/л; С Al2(SO4)3 = 0,0006 моль/л, V Al2(SO4)3 = 0,03 л. Найти V BaCl2. Написать формулу мицеллы золя. Р е ш е н и е. Образование золя BaSO4 происходит в соответствии с уравнением реакции: 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2 AlCl3 Если вещества участвуют в стехиометрическом соотношении, то справедливо соотношение: (CV)BaCl2 = (CV) Al2(SO4)3, следовательно V BaCl2 = Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Значит, для реакции необходимо взять более 0,009 л 0,002М раствора BaCl2. Формула мицеллы золя сульфата бария: {[mBaSO4] ×nBa2+ 2(n-x)Cl– }2x+×2xCl– Пример 3. Золь сульфида цинка был получен при взаимодействии растворов Zn(NO3)2 и Na2S. Определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к аноду. Напишите формулу мицеллы золя. Р е ш е н и е. Образование золя ZnS происходит в соответствии с уравнением реакции: Zn(NO3)2 + Na2S = ZnS + 2NaNO3 Анод – положительно заряженный электрод, к нему движутся отрицательно заряженные частицы. Значит противоионы мицеллы имеют отрицательный заряд, а сама мицелла заряжена положительно, что возможно при условии избытка Zn(NO3)2. На поверхности агрегата ZnS адсобируются потенциалопределяющие ионы Zn2+ (так как раствор Zn(NO3)2 в избытке), создавая таким образом положительный заряд мицеллы. Агрегат и потенциалопределяющие ионы образуют ядро, с которым связываются противоионы – NO3–. Таким образом, в избытке был взят раствор Zn(NO3)2. Формула мицеллы золя иодида серебра при условии избытка Zn(NO3)2: {[m ZnS ] ×nZn2+ 2(n-x)NO3–} 2x+×2xNO3– Растворы неэлектролитов Растворы неэлектролитов состоят из незаряженных частиц. Они могут быть образованы различными парами органических жидкостей, например бензолом и толуолом. Установлено, что молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Согласно закону Рауля понижение давления DP насыщенного пара растворителя над раствором пропорционально мольной доле растворенного нелетучего вещества ni: DP = P0 – P = P0 ni, или где Р 0 – давление насыщенного пара растворителя над чистым растворителем; P – давление насыщенного пара растворителя над раствором, DP – разность между давлениями насыщенного пара растворителя над раствором P и растворителем Р 0; n – количество растворенного вещества в растворе (моль); N – количество вещества растворителя (моль); ni – мольная доля растворенного вещества. Из закона Рауля возникают два следствия. 1. Температура кипения раствора выше температуры кипения растворителя. Повышение температуры кипения DТкип пропорционально моляльной концентрации раствора сm: DТкип = Кэсm, (24) где Кэ – эбулиоскопическая постоянная растворителя.
где g – масса растворенного вещества, г; G – масса растворителя, г; 2. Температура замерзания раствора ниже температуры замерзания чистого растворителя. Понижение температуры замерзания DТзам пропорционально моляльной концентрации раствора сm: DТзам = Кксm, (26) где Кк – криоскопическая постоянная. Значения Кэ и Кк зависят от природы растворителя. Используя уравнения
где DТ – изменение температуры кипения или замерзания раствора; Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку (мембрану), которая пропускает только молекулы растворителя. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа: pV=nRT; где p – осмотическое давление (Па); n – количество вещества (моль); V – объем раствора (м3); С – молярная концентрация раствора, R – универсальная газовая постоянная, 8,3144 Дж/(моль×К).
Примеры решения задач. Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,4 л Д а н о: m = 63 г, V = 1,4 л, Т = 00С. Найти p. Р е ш е н и е. Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
Пример 2. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола С6Н5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы соответственно равны 2,57 и 5,10С. Температура кипения чистого бензола 80,20С, температура замерзания –5,40С. Д а н о: g = 1 г, G = 10 г, Кэ = 2,570С, Кк = 5,10С, Тк бенз = 80,20С, Тз бенз = –5,40С. Найти Тк р-ра и Тз р-ра Р е ш е н и е 1) Из закона Рауля следует, что
2) Рассчитаем молярную массу нитробензола: Mr (C6H5NO2) = 123,11 г/моль. 3) Повышение температуры кипения раствора нитробензола в бензоле:
4) Температура кипения раствора: Тк = 80,2 + 2,09 = 82,290С. 5) Понижение температуры замерзания раствора нитробензола в бензоле:
6) Температура замерзания раствора: Тз = 5,4 – 4,14 = 1,260С. Пример 3. Раствор камфоры массой 0,552 г в 17 г эфира кипит при температуре на 0,4610С выше, чем чистый эфир. Эбулиоскопическая постоянная эфира 2,160С. Определите молекулярную массу камфоры. Д а н о: g = 0,552 г, G = 17 г, Кэ = 2,160С. Найти Mr камфоры Р е ш е н и е. Молекулярную массу камфоры можно определить, пользуясь соотношением
Таким образом, молекулярная масса камфоры равна 155,14 г/моль. Пример 4. Вычислите давление пара над раствором, содержащим 34,23 г сахара С12Н22О11, в 45,05 г воды при 650С, если давление паров воды при этой температуре равно 2,5×104 Па. Д а н о: m(С12Н22О11) = 34,23 г, m (H2O) = 45,05 г, Р0 = 2,5×104 Па. Найти Р. Р е ш е н и е. 1) Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением 2) Рассчитаем молярные массы сахара и воды: М (С12Н22О11) = 342,30 г/моль, М (Н2О) = 18,02 г/моль. 3) Найдем количество растворенного вещества и растворителя:
4) Давление пара над раствором:
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 625; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.83.96 (0.013 с.) |

 [моль/л], (14)
[моль/л], (14) [моль/кг], (16)
[моль/кг], (16) (17)
(17) , (18)
, (18) (19)
(19)
 , mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль
, mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль , т.е. 0,25 моль NaOH содержится в 100 г раствора.
, т.е. 0,25 моль NaOH содержится в 100 г раствора. = 0,091 л
= 0,091 л





 , (23)
, (23) (25)
(25) , (27)
, (27) ; p =СRT, (28)
; p =СRT, (28) , следовательно, в 1,4 л раствора содержится 0,35 моль глюкозы. Осмотическое давление этого раствора:
, следовательно, в 1,4 л раствора содержится 0,35 моль глюкозы. Осмотическое давление этого раствора:
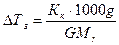 ,
, 





 ,
, 




