Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергия сродства к электрону (сродство атома к электрону)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Атомы могут не только отдавать, но и присоединять электроны. Экспериментальные данные показывают, что для некоторых атомов выделяемая энергия притяжения дополнительного электрона к ядру атома превышает затрачиваемую энергию отталкивания этого электрона от электронных оболочек атома. Такие атомы могут присоединять электрон, образуя устойчивый отрицательный однозарядный ион (Cl− и др.). Для других атомов присоединение электрона сопровождается затратой энергии. Энергия, которая выделяется или затрачивается при присоединении электрона к нейтральному атому Эо с превращением его в отрицательный ион Э−, называется энергией сродства к электрону (или сродством к электрону). Эо + 1е = Э− ± Еср. Например, Clo + 1e = Cl− + Eср Энергия сродства к электрону Еср может быть как положительна (если она выделяется), так и отрицательна (если она затрачивается). Сродство к электрону численно равно, по противоположно по знаку энергии ионизации отрицательно заряженного иона Э−. Оно выражается в кДж/моль или эВ/атом. Наибольшим сродством к электрону обладают галогены (F, Cl, Br, J), то есть при присоединении к атомам галогенов электрона выделяется больше всех энергии. И, наоборот, сродство к электрону атомов большинства металлов отрицательно, то есть присоединение электрона в этом случае энергетически невыгодно. В периодах сродство к электрону атомов слева направо растет, а в главных группах уменьшается сверху вниз, поэтому неметаллические свойства элементов усиливаются по мере приближения к концу периода. Электроотрицательность элементов Комплексной характеристикой атома, учитывающей его способность как присоединять электроны, так и отдавать электроны, является электроотрицательность элемента. Электроотрицательность элемента – это величина, характеризующая способность атомов этого элемента оттягивать к себе электроны от других атомов в молекуле (в химическом соединении). Таким образом, при образовании химической связи между двумя атомами разных элементов общая электронная пара смещается к атому более электроотрицательного элемента, причем это смещение электронов будет тем больше, чем больше различаются электроотрицательности двух связанных атомов. Например, в молекуле HCl общая электронная пара смещена к атому более электроотрицательного хлора. Очевидно, способность атома оттягивать электроны зависит от энергии ионизации атома и его сродства к электрону. Электроотрицательность элемента – это расчетная величина, а не экспериментальная. Пользоваться абсолютными значениями электроотрицательности элементов неудобно. На практике пользуются относительными электроотрицательностями элементов (ОЭО) по Полингу, приняв относительную электроотрицательность лития за единицу. Электроотрицательность элементов в таблице Д.И.Менделеева тоже изменяется периодически. В периоде слева направо ОЭО элементов увеличивается, а в главных группах уменьшается. Чем более типичным металлом является элемент тем меньше его ОЭО. И, наоборот, чем больше ОЭО элемента, тем сильнее он проявляет неметаллические свойства. Наибольшую электроотрицательность имеет фтор, поэтому он – самый активный неметалл и самый сильный окислитель. Таким образом, из квантово-механической теории следует, что электроотрицательность, энергия ионизации и другие свойства элементов, определяются строением электронной оболочки атомов. При образовании химических связей строение электронной оболочки атомов является решающим фактором.
5. Химическая связь. Понятие о методе валентных связей. Основные характеристики химической связи: энергия, длина, направленность, полярность молекул. Валентность и максимальная ковалентность атомов.
Химической связью называется совокупность электростатических взаимодействий между отрицательно заряженными электронами и положительно заряженными ядрами атомов, приводящих к соединению атомов в молекулу, ионный кристалл и другие устойчивые многоатомные системы.
Вскоре после разработки квантово-механической модели строения атома началась разработка квантово-механической теории химической связи. В настоящее время для объяснения образования химической связи применяются два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В 1927 г. немецкие теоретики В.Гайтлер и Ф.Лондон предложили теорию, которую назвали методом валентных связей (ВС). Большой вклад в развитии этого метода внесли также Л.Полинг и Д.Слейтер. Несколько позже, в 1928 – 32 гг. Т.Гунд и Р.Малликен разработали другую теорию химической связи, которую назвали методом молекулярных орбиталей (МО). Оба метода позволяют довольно точно рассчитать важнейшие характеристики химической связи, поэтому оба метода правильно отражают природу взаимодействий между электронами и ядрами атомов. В зависимости от поставленных задач и объектов исследования в одних случаях используют более наглядный метод ВС, в других случаях применяют метод МО. Метод валентных связей исходит из положения, что каждая пара атомов в молекуле образуют между собой химическую связь при помощи одной или нескольких общих электронных пар. Таким образом, химическая связь образуется по методу ВС за счет общей электронной пары и эта связь локализована (расположена) между двумя атомами, то есть она двухэлектронная и двухцентровая. Поэтому метод ВС называется также методом локализованных электронных пар (ЛЭП). Основные положения метода валентных связей следующие: 1. Ковалентная химическая связь образуется двумя электронами с антипараллельными спинами, причем эта общая электронная пара принадлежит двум связываемым атомам. (Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.) При этом происходит перекрывание электронных облаков и между ядрами атомов значительно увеличивается электронная плотность, что приводит к уменьшению потенциальной энергии системы, то есть к образованию химической связи. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Например, Н: Н, 2. Ковалентная химическая связь тем прочнее, чем больше степень перекрывания электронных облаков взаимодействующих атомов. Таким образом, из двух или нескольких орбиталей атома более прочную химическую связь образует та, которая сильнее перекрывается орбиталью другого атома. 3. Ковалентная связь образуется в таком направлении, в котором перекрывание взаимодействующих электронных облаков, образующих химическую связь, максимально (в этом случае образуется самая прочная связь). Исходя из этих положений метод валентных связей дает теоретическое обоснование направленности ковалентной связи. Этот метод по сути дела основан на представлениях Г.Льюиса о ковалетной связи, но с применением квантово-механической модели строения атома (Льюис рассматривал электрон только как частицу, а по теории квантовой механики изображение электрона рассматривалось в виде электронного облака). Метод ВС является первой теорией химической связи, в которой применяются квантово-механические предоставления. Она позволяет ответить на многие вопросы, касающиеся химической связи, хорошо методически разработана, наглядна и поэтому широко используется в учебной и научной литературе, несмотря на постулативность отдельных её положений и несостоятельность в решении некоторых вопросов химической связи.
Важной характеристикой химической связи является её прочность. Мерой прочности химических связей является энергия связи. ║ Энергия химической связи – это есть энергия, затрачиваемая на разрыв связи: А–В = А + В - Есв За энергию связи можно также считать энергию, которая выделяется при образовании химической связи: А + В = АВ + Есв Для двухатомных молекул энергия связи равна величине энергии диссоциации молекулы на атомы. Чем больше энергия связи, тем связь прочнее. В качестве единицы измерения энергии химической связи используют кДж/моль. Энергия химической связи зависит от природы и количества атомов, образующих связь, от кратности связи между атомами. Так, энергия связи в молекуле Н2 составляет 436 кДж/моль, в молекуле фтора F2 она равна 159 кДж/моль, в молекуле HCl имеет значение 431 кДж/моль. Энергию химической связи определяют с помощью закона Гесса на основе энтальпий реакций, при которых образуется или разрывается изучаемая химическая связь. Другой важной характеристикой химической связи является её длина. ║ Длиной химической связи называют расстояние между центрами атомов, образующих химическую связь между собой, то есть расстояние между ядрами связываемых атомов. Длина химической связи определяется рентгеноструктурным анализом и другими физическими методами. В качестве единицы измерения длины химической связи удобно использовать пикометр (пм) или нанометр (нм): 1 пм = 10-12 м, 1нм = 10-9 м. Современные методы исследования структуры веществ позволяют определять длины химических связей с точностью до 10-2 пм. В зависимости от природы атомов, образующих между собой химическую связь, и от кратности связи между атомами длины химических связей изменяются от нескольких десятков пикометров до 300 – 400 пм. Как правило, в однотипных соединениях с увеличением энергии химической связи длина связи уменьшается, с увеличением кратности связи уменьшается межъядерное расстояние, вследствие чего и длина химической связи уменьшается.
Ковалентная связь обладает свойствами насыщаемости, направленности и поляризуемости. Разберем эти свойства. Одним из важнейших свойств ковалентной связи является её насыщенность. Вследствие насыщаемости связи молекулы имеют определенный состав (Н2О, HCl, H3N и др.) и существуют в виде дискретных частиц с определенной структурой. ║ Насыщаемость ковалентной связи – это есть число ковалентных связей, которое способен образовать данный атом с другими атомами. Она характеризует способность атома образовывать ограниченное число ковалентных связей с другими атомами. Насыщаемость связи определяется природой и валентной структурой атома. Разберем это свойство для атомов некоторых элементов. 1. Атом водорода (элемента 1 периода) имеет одну валентную 1S-орбиталь, на которой находится неспаренный валентный электрон, за счет которого атом Н может образовать одну ковалентную связь по обменному механизму, то есть максимальная ковалентность атома водорода равна числу валентных орбиталей и равна единице (Н – Н, Н – Cl). 2. Атом углерода (элемента 2 периода) имеет 4 валентные орбитали и на внешнем энергетическом уровне находятся 4 валентных электрона, два из которых являются неспаренными, поэтому атом углерода может по обменному механизму образовать 2 ковалентные связи: Е ↑ С │↑│↑│ │ │…│↑↓│ 2р │ 2S │ Но для углерода характерно образование четырех ковалентных связей. Число неспаренных электронов может увеличиться в результате возбуждения атома углерода, вызывающего распад двухэлектронного 2S-облака на одноэлектронные и переход одного из 2S-электронов на свободную орбиталь 2р – подуровня (то есть происходит возбуждение одного из 2S-электронов в 2р-состояние): Е ↑ С │↑│↑│ │ ―――――――→ С* │↑│↑│↑│ │…│↑↓│ 2р … │↑│ │ 2S │ Возбуждение атома углерода, то есть перевод 2S-электрона на 2р-подуровень требует затраты энергии в количестве 401 кДж/моль. Однако в результате возбуждения у атома углерода станет 4 неспаренных электрона, за счет которых он может образовать 4 ковалентные связи. Поэтому энергия, затрачиваемая на возбуждение атома, с избытком компенсируется энергией, выделяемой при образовании двух дополнительных ковалентных связей (по сравнению с основным состоянием атома углерода), вследствие чего возбуждение атома углерода в целом будет энергетически выгодно. Отметим, что возбуждение атома будет энергетически выгодно (а, значит, может реально происходить), если оно осуществляется в пределах одного энергетического уровня (например, у атома углерода происходит в пределах второго энергетического уровня). Таким образом, максимальная ковалентность углерода (ковалентность атома – это число образуемых им ковалентных связей) равна числу валентных орбиталей и равна 4. 3. Атом азота на 4 валентных орбиталях содержит 5 валентных электрона, три из которых неспаренные: Е ↑ N │↑│↑│↑│ │…│↑↓│ 2р │ 2S │ За счет трех неспаренных электронов атом азота образует 3 ковалентные связи, например, с тремя атомами водорода, у которых имеется по одному неспаренному электрону, при этом образуется молекула аммиака NH3 в результате создания трех общих электронных пар: Н 2р : Н N │↑↓│ ∫ ∫ ∫ │↓│↓│↓│ H H H Кроме того, у азота еще осталась неиспользованной неподеленная электронная пара, поэтому за счет этой пары электронов азот может образовать, например, с ионом Н+ еще одну (четвертую) ковалентную связь. При этом на образование этой связи атом азота отдает два электрона, а ион водорода (□Н+) примет эту электронную пару на свою свободную валентную орбиталь. Такая ковалентная связь называется донорно-акцепторной связью, причем атом азота будет называться донором электронной пары, а ион Н+ называется акцептором электронной пары. Атом азота в итоге образовал 4 ковалентные связи: три ковалентные связи образованы по обменному механизму с участием неспаренных электронов азота и одна ковалентная связь - по донорно-акцепторному механизму. Таким образом, образование иона NH4+ описывается методом валентных связей как результат создания четырех общих электронных пар. Н ┌ Н ┐+ 2р Н: Н └ Н ┘ N │↑↓│ ∫ ∫ ∫ ∫ │↓│↓│↓│ Ž H+ H H H В образовавшемся ионе аммония NH4+ азот проявляет максимальную ковалентность, которая равна числу валентных орбиталей и равна четырем. Рассмотренные примеры показывают, что ковалентные связи могут образовываться за счет неспаренных электронов невозбужденного атома, а также за счет неспаренных электронов, появляющихся в результате возбуждения атома. Кроме того, ковалентные связи могут образовываться по донорно-акцепторному механизму. Однако максимальное число ковалентных связей, которое способен образовать данный атом с другими атомами, определяется общим числом валентных орбиталей этого атома. К валентным орбиталям принадлежат орбитали внешнего (валентного) энергетического уровня, а для d-элементов в качестве валентных орбиталей используются также d-орбитали предвнешнего энергетического уровня. Атомы элементов 1 периода (водород) имеют одну валентную 1S-орбиталь и максимальная ковалетность водорода равна единице. Атомы элементов второго периода имеют на внешнем энергетическом уровне 4 валентные орбитали, поэтому максимальная ковалетность элементов второго периода равна четырем, например: [BeF4]2-, [BF4]-, CH4, [NH4]+. Атомы элементов третьего и последующих периодов для образования ковалентных связей могут использовать не только s- и р-орбитали, но также и d-орбитали, поэтому ковалентность этих элементов может быть значительно больше четырех, например, [PF6]-, SF6, Cl2O7, JF7.
Образование ковалентной связи является результатом перекрывания валентных электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков. Только s-орбитали сферической формы имеют одинаковую направленность. Что касается р- и d-орбиталей, то они направлены по координатным осям и имеют различную форму. В соответствии с направленностью атомных орбиталей происходит и их перекрывание при образовании ковалентной связи, поэтому и ковалентная связь обладает свойством направленности. Представление о направленности ковалентных связей позволяет объяснить взаимное расположение атомов в многоатомных молекулах. Например, молекула H2S образуется из атома серы и двух атомов водорода. Атом серы имеет два неспаренных 3р-электрона, которые занимают две р-орбитали, расположенные по координатным осям под углом 90о друг к другу. Атомы водорода имеют по одному неспаренному 1S-электрону. Таким образом, в молекуле H2S образуются две σ-связи за счет перекрывания электронных облаков двух неспаренных 3р-электронов атома серы с 1s-электронными облаками двух атомов водорода. Так как 3р-орбитали атома серы ориентированы во взаимно перпендикулярных направлениях, то молекула H2S имеет угловое строение и валентный угол в этой молекуле (валентный угол – это угол между двумя химическими связями) должен быть равен 90о. Однако он равен 92о. Это можно объяснить электростатическим отталкиванием одноименных зарядов δ+ двух атомов водорода (так как связь S – H полярна), поэтому валентный угол увеличивается с 90о до 92о.
Рис. 10.7. Образование молекулы H2S согласно методу ВС.
Направленность ковалентной связи зависит также от типа гибридизации валентных орбиталей атома.
6. Понятие о гибридизации атомных орбиталей. Примеры с участием разных атомных орбиталей. Геометрия молекул. Дипольные моменты и полярность молекул.
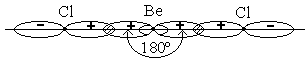
Метод валентных связей позволяет объяснить образование и свойства химических связей между атомами во многих простых веществах и химических соединениях. Но в ряде случаев наблюдаются явные расхождения экспериментальных данных и теоретических расчетных данных, полученных по этому методу. Так, в образовании химических связей могут участвовать различные орбитали атома (s-, p-, d- и f-орбитали), которые имеют различную энергию, различную форму и различное расположение в пространстве. Однако в некоторых молекулах характеристики всех образуемых связей (энергия, длина, полярность связи) бывают одинаковыми. Например, в молекуле метана СН4 атом углерода четырехвалентен. В соответствии с первым положением метода ВС четыре ковалентные связи с атомами водорода образуются благодаря наличию 4 валентных неспаренных электронов в возбужденном атоме углерода 2s12p3. При этом три ковалентные связи С – Н, образованные за счет трех р-электронов, должны быть равноценны и валентные углы между ними должны быть равны 90о, так как р-орбитали направлены по координатным осям под углом 90о друг к другу. Четвертая связь образована за счет неспаренного 2s-электрона атома углерода и она должна отличаться от остальных трех связей по своим характеристикам. Так, связи, образованные р-электронами атома углерода, должны быть более прочными (больше энергия связи), так как р-орбитали более вытянуты от ядра, чем s–орбиталь, и поэтому сильнее перекрывают орбитали атомов водорода. Оказалось, что теоретические предсказания метода ВС в данном случае противоречат хорошо известным экспериментальным данным о равноценности всех четырех связей С – Н в молекуле метана: прочность, длина и полярность всех связей в молекуле СН4 одинаковы. Валентные углы между всеми 4 связями тоже одинаковы и равны 109о28′, причем все связи атома углерода направлены к вершинам тетраэдра, атом углерода расположен в центре, а атомы водорода – в вершинах тетраэдра. Каким же образом неравноценные по исходному состоянию электроны атома углерода образуют равноценные химические связи? Теоретическое объяснение этому дает теория гибридизации валентных атомных орбиталей, предложенная американским ученым Л.Полингом (лауреат Нобелевской премии по химии в 1954 г.). Полинг предложил усовершенствовать метод ВС, выдвинув дополнительное положение этого метода о возможности гибридизации атомных орбиталей при образовании химических связей. ║ Гибридизация атомных орбиталей – это процесс смешивания (сложения, комбинирования) различных по энергии и форме атомных орбиталей с образованием такого же числа новых, но уже одинаковых по энергии и форме гибридных («смешанных») орбиталей. Таким образом, согласно представлениям Л.Полинга, химические связи образуются электронами не «чистых» исходных атомных орбиталей (s-, p- или d-типа), а «смешанных» гибридных орбиталей, образуемых при смешении исходных атомных орбиталей. Гибридная орбиталь сильно вытянута по одну сторону от ядра атома, чем по другую, то есть электронная плотность в ней сконцентрирована по одну сторону от ядра в большей степени, чем по другую, что обусловливает гораздо более сильное перекрывание гибридных орбиталей с орбиталями других атомов, чем перекрывание негибридных орбиталей s- и р-электронов. В соответствии со вторым положением метода ВС это приводит к образованию более прочной связи. Поэтому гибридизация приводит к образованию более устойчивых молекул. Название гибридных орбиталей и тип гибридизации определяется числом и типом складываемых исходных валентных атомных орбиталей. Так, при образовании молекулы метана складываются 4 валентные атомные орбитали углерода и образуются четыре sp3-гибридные орбитали. Соответственно говорят, что имеет место sp3-гибридизация валентных орбиталей атома углерода. Гибридные орбитали данного атома образуют ковалентные связи в соответствии с первым положением метода ВС так же, как и обычные негибридные атомные орбитали: путем перекрывания с орбиталями другого атома. Так, четыре sp3-гибридные орбитали атома углерода, перекрываясь с четырьмя 1s-орбиталями атомов водорода, образуют 4 одинаковые связи в молекуле СН4. Валентный угол между связями равен 109о28′. Таким образом, метод ВС в модифицированной форме Полинга дает согласие с экспериментальными данными. Гибридизация атомных орбиталей валентных электронов характерна не только для соединений углерода. Представление о гибридизации необходимо использовать всегда, когда несколько одинаковых связей образуют различные валентные электроны, не очень сильно отличающиеся по энергии (значительное различие энергии электронов препятствует гибридизации). Существуют следующие основные типы гибридизации атомных орбиталей. Гибридизация одной s- и одной р-орбитали (sp-гибридизация), приводящая к образованию двух гибридных sp-орбиталей, направленных под углом 180о друг к другу, что приводит к линейному строению молекулы. Например, sp-гибридизация валентных орбиталей наблюдается при образовании галогенидов бериллия, цинка, кадмия и ртути. Например, молекула BeCl2 линейна, а обе связи Ве – Cl в этой молекуле равноценны по энергии и длине.
Рис. 10.8. Схема образования ковалентных связей в молекуле BeCl2 (sp-гибридизация валентных орбиталей бериллия).
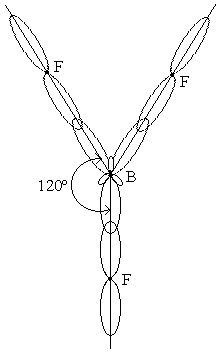
Благодаря вытянутой форме гибридных sp-орбиталей атома бериллия достигается более полное перекрывание взаимодействующих электронных облаков, а, значит, образуются более прочные химические связи в BeCl2. При этом, энергия, выделяющаяся при образовании двух связей (Ве – Cl) больше, чем суммарные затраты энергии на возбуждение атома бериллия и деформацию его атомных орбиталей при их гибридизации. Поэтому процесс образования молекулы BeCl2 энергетически выгоден. Гибридизация одной s- и двух р-орбиталей (sp2-гибридизация) приводит к образованию трех гибридных одинаковых sp2орбиталей, лежащих в одной плоскости и ориентированных под углами 120о друг к другу. Этому типу гибридизации соответствует образование плоской треугольной молекулы (рис. 10.9.).
Рис. 10.9. Схема образования ковалентных связей в молекуле BF3 (sp2-гибридизация атомных орбиталей бора).
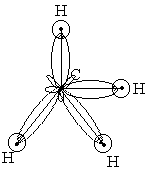
Гибридизация одной s- и трех р-орбиталей (sp3-гибридизация) приводит к образованию четырех гибридных sp3-орбиталей, направленных к четырем вершинам тетраэдра и ориентированных под углами 109о28′ друг к другу (рис. 10.10). Такая гибридизация характерна для некоторых соединений углерода, кремния, германия, фосфора и др.
Рис. 10.10. Схема образования ковалентных связей в молекуле СН4 (sp3-гибридизация атомных орбиталей углерода).
У элементов третьего и последующих периодов в гибридизации могут участвовать валентные d-орбитали. Например, при гибридизации одной s-, трех р- и двух d-орбиталей (sp3d2-гибридизация) образуются шесть равноценных гибридных sp3d2 – орбиталей, направленных к вершинам октаэдра. Такой тип гибридизации валентных орбиталей центрального атома осуществляется при образовании молекулы SF6, а также ионов [PF6]-, [SiF6]2- и др. При гибридизации одной s-, трех р- и одной d-орбитали (sp3d1 – гибридизация) образуются молекулы или сложные ионы, имеющие форму тригональной бипирамиды, например, галогениды фосфора (V). Основные положения теории гибридизации атомных орбиталей: 1. Число гибридных орбиталей всегда равно числу исходных смешиваемых орбиталей. 2. В гибридизации могут принимать участие только валентные атомные орбитали. 3. Гибридизация происходит только с орбиталями одного атома. 4. Формы гибридных орбиталей и их расположение в пространстве получаются различными в зависимости от числа и вида исходных смешиваемых атомных орбиталей. 5. При гибридизации изменяется форма атомных орбиталей, расположение гибридных орбиталей в пространстве соответствует самому энергетически выгодному состоянию, при котором взаимодействие орбиталей будет минимальным (минимальное взаимное отталкивание). 6. Гибридизация атомных орбиталей энергетически выгодна, так как энергия, затрачиваемая на деформацию исходных орбиталей с избытком компенсируется за счет дополнительной энергии, выделяемой при более полном перекрывании гибридных орбиталей по сравнению с негибридными s- и р-орбиталями. 7. Валентные атомные орбитали, которые подвергаются гибридизации, должны не очень сильно отличаться по энергии. В периоде слева направо возрастает энергетическое различие внешних s- и р-орбиталей, поэтому в этом направлении уменьшается устойчивость гибридов (частиц) при смешении s- и р-орбиталей. 8. Перекрывание гибридных орбиталей с орбиталями соседних атомов должно происходить в достаточной степени, то есть образовавшаяся химическая связь должна быть достаточно прочной. Поэтому гибридизируются (смешиваются) только достаточно плотные орбитали. Так, в ряду H3N, H3P, H3As, SbH3 электронное облако центрального атома становится все более размазанным (электронная плотность уменьшается). При этом способность атомных орбиталей центрального атома к гибридизации уменьшается от H3N к SbH3, то есть устойчивость sp3-гибридного состояния уменьшается. 9. Гибридные атомные орбитали участвуют в образовании только σ-связей (некоторые из них могут не участвовать в образовании связей); π-связи образуются при участии негибридных атомных орбиталей.
Каждая многоатомная молекула (или ион) представляет собой систему взаимосвязанных атомов, расположенных в пространстве определенным образом относительно друг друга, то есть характеризуется определенным пространственным строением или геометрией. Раздел химии, изучающий пространственное строение частиц, называется пространственной химией или стереохимией. Пространственная конфигурация многоатомных молекул и ионов определяется природой и числом атомов, образующих молекулу, то есть зависит от формы и размера валентных орбиталей, а также от способа их перекрывания при образовании химических связей. Пространственная направленность ковалентных связей как раз и определяет пространственное строение многоатомной частицы, которое зависит также от типа гибридизации валентных орбиталей центрального атома в данной молекуле (ионе). Таблица 10.1. Геометрические формы многоатомных молекул и ионов
Если химическая связь образуется между атомами равных размеров и с одинаковой электроотрицательностью (например, в молекулах Н2, Cl2, N2), то электронное облако, образованное общей электронной парой и осуществляющее ковалентную связь, распределяется симметрично относительно ядер двух связанных атомов. В этом случае образуется неполярная ковалентная связь. Если электроотрицательности связанных атомов различны, но не сильно отличаются друг от друга, то происходит смещение общей электронной пары к более электроотрицательному атому и образуется полярная ковалентная связь. Например, в молекуле HCl общая электронная пара смещена в сторону более электроотрицательного атома хлора, в результате чего на атоме хлора возникает избыточный эффективный отрицательный заряд δ-, а на атоме водорода возникает такой же по абсолютной величине положительный заряд δ+. Полярность химической связи количественно выражается дипольным моментом связи (электрический момент диполя), который рассчитывают по формуле: Мс = δ•ℓ, (10.1.) где Мс – дипольный момент химической связи; ℓ - длина химической связи; δ – абсолютная величина эффективного заряда атома, образующего химическую связь.
В качестве единицы измерения дипольного момента используют Кл•м (кулон • метр) или внесистемную единицу Дебай (Д), при этом 1Д = 3,3•10-30Кл•м. Ч ем больше значение дипольного момента химической связи, тем связь более полярна. Для HCl дипольный момент связи равен 1,08Д или 0,347•10-29Кл•м. Для неполярной ковалентной связи дипольный момент равен нулю. Дипольный момент связи зависит от разности электроотрицательностей двух атомов, образующих между собой химическую связь. Для характеристики реакционной способности молекулы важно знать не только исходное распределение электронной плотности в молекуле, но и легкость, с которой оно изменяется, то есть поляризуемость. Поляризуемость ковалентной связи – это есть способность ковалентной связи поляризоваться в результате действия внешнего электрического поля (или при действии иона или другой полярной молекулы, например, партнера по реакции). При этом неполярная ковалентная связь становится полярной, а полярная ковалентная связь становится более полярной. Поляризуемость ковалентной связи зависит от эффективного заряда атомов, образующих связь, от размера атомов и формы орбиталей.
При образовании химической связи между двумя атомами различных элементов электронная плотность около атомов изменяется. Это изменение можно учесть, приписав атому некоторый эффективный заряд δ (в единицах заряда электрона). Эффективный заряд атома – это заряд, который возникает на атомах при образовании химической связи между ними вследствие смещения электронной плотности (общей электронной пары) к атому более электроотрицательного элемента. Согласно экспериментальным данным, в молекуле HCl эффективный положительный заряд на атоме водорода составляет δ+ = +0,18, а эффективный отрицательный заряд на атоме хлора δ- = -0,18 абсолютного заряда электрона, то есть химическая связь в молекуле HCl имеет на 18% ионный характер, а на 82% имеет ковалентный характер, то есть в HCl ковалентная полярная связь. Чем больше разность электроотрицательностей двух связанных атомов, тем больше на них возникает эффективный заряд. Эффективный заряд можно рассматривать как меру поляризации химической связи. В случае образования неполярной ковалентной связи (например, Н2, Cl2) эффективный заряд на атомах равен нулю, то есть степень ионности таких связей равна нулю и они на 100% имеют ковалентный характер. В случае ионного соединения (например, NaCl) эффективный заряд на атоме натрия δ+ = +0,8, а на атоме хлоре δ- = -0,8, то есть химическая связь на 80% имеет ионный характер. Значения эффективных зарядов для атомов – аналогов в однотипных соединениях изменяются закономерно. Так, в ряду галогеноводородов отрицательный эффективный заряд на атоме галогена уменьшается по абсолютной величине от –0,45 для фтора до –0,05 для йода. Эффективные заряды определяют различными методами: на основании изучения оптических спектров поглощения, рентгеновских спектров поглощения, ядерного магнитного резонанса и др.
Недостатки метода валентных связей
До сих пор рассматривался метод валентных связей, по которому ковалентная связь образуется за счет общих электронных пар, которые связывают два атома, то есть ковалентная связь является двухэлектронной и двухцентровой. Однако метод ВС не является всеобъемлющим и имеет ряд недостатков: · Метод ВС объясняет образование только двухэлектронных связей, но есть частицы, в которых имеются одноэлектронные и трёхэлектронные химические связи (Н2+, Н2-). · Метод ВС не рассматривает изменения энергии электронов при образовании химической связи. Согласно этого метода электроны при образовании химической связи занимают какое-то новое положение, сохраняя свою индивидуальность (А• + •В → А: В). · Метод ВС не объясняет образование химических связей с атомами инертных элементов. · На основе метода ВС трудно объяснить, что отрыв электронов от некоторых молекул приводит к упрочнению химической связи. Так, энергия связи в молекуле О2 равна 494 кДж/моль, а в мол
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 3271; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.5 (0.017 с.) |

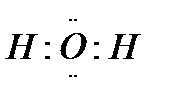 , то есть валентные электроны внешнего электронного слоя обозначают точками вокруг химического символа атома, а общие для двух атомов электроны показывают точками, помещаемыми между химическими символами этих атомов.
, то есть валентные электроны внешнего электронного слоя обозначают точками вокруг химического символа атома, а общие для двух атомов электроны показывают точками, помещаемыми между химическими символами этих атомов.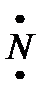 • + 3 •H →:
• + 3 •H →:  : Н или 2S │↑│↑│↑│
: Н или 2S │↑│↑│↑│ : + Н+ → │Н:
: + Н+ → │Н: