
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость гомогенной реакции равна изменению концентрации исходного вещества или продукта реакции (то есть любого участника реакции) в единицу времени.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
О скорости реакции можно судить по изменению концентрации исходных веществ или получаемых продуктов реакции, так как они связаны между собой стехиометрическими коэффициентами. Следует лишь учесть, что концентрация исходных веществ убывает (∆с < 0), а продуктов реакции возрастает (∆с > 0) (рис.3.1.).
Рис. 3.1. Зависимость концентрации исходного вещества (кривая 1) и продукта реакции (кривая 2) от времени реакции. Скорость реакции всегда считается положительной. Отношение же В зависимости от единиц измерения концентрации и времени скорость реакции может выражаться в
Зако́н де́йствующих масс устанавливает зависимость скорости химической реакции от концентрации исходных веществ. При постоянной температуре скорость гомогенной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, равной стехиометрическому коэффициенту перед формулой данного вещества в уравнении реакции (для простых реакций). Например, для гомогенной реакции nA + mB → рС закон действия масс имеет вид:
где V – скорость реакции, СА и СВ – концентрации реагирующих веществ А и В (моль/л), k – коэффициент пропорциональности между скоростью реакции и произведением концентраций и называется константой скорости реакции. Это величина постоянная при данных условиях данной реакции. Она характеризует реакционную способность реагирующих веществ, то есть тенденцию реакции к протеканию. Чем больше значение k, тем быстрее протекает реакция. Наряду со скоростью, константа скорости химической реакции является основной величиной в химической кинетике. Из уравнения (3.12) следует, что если концентрации всех реагентов равны единице, то константа скорости реакции численно равна скорости химической реакции: k = V если СА = СВ = 1 моль/л. Величина константы скорости реакции зависит от: а) природы реагирующих веществ, б) температуры, в) присутствия катализатора и не зависит от концентрации реагирующих веществ. Закон действия масс непосредственно справедлив для простых реакций, протекающих в одну стадию. В этом случае показатели степени «n» и «m» в уравнении скорости реакции действительно будут равны стехиометрическим коэффициентам в уравнении химической реакции. В случае сложных реакций, состоящих из двух и более простых реакций, закон действия масс приложим к любой из этих простых реакций в отдельности, но не к сложной реакции в целом. Для сложной реакции показатели степени «n» и «m» в уравнении закона действия масс устанавливаются экспериментальным путем. Необходимо отметить, что закон действия масс для газовых реакций является строгим только в случае идеальных газов. Он применим также и к реакциям в разбавленных растворах (строго только для бесконечно разбавленных растворов). Для гетерогенных реакций закон действия масс применяется с некоторыми ограничениями. Например, если для реакции С(тв) + О2(г) → СО2(г) использовать закон действия масс формально, то получим: V = k•CC• Но реакция идет на поверхности твердого тела (углерода), поэтому количество частиц углерода изменяется не сильно по сравнению с общим количеством данного вещества. Таким образом, концентрация твердого углерода мало влияет на скорость реакции. Изменением концентрации твердого тела можно пренебречь и считать её постоянной величиной, поэтому концентрацию твердой фазы можно внести в константу скорости k. Тогда скорость горения твердого углерода определяется концентрацией газообразного кислорода, и уравнение закона действия масс запишется так: υ = k΄ где k΄ = k•CC = const.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко. Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции. Кинетическое уравнение реакции только для элементарных стадий совпадает с выражением ЗДМ. В этих случаях молекулярность и порядок реакции совпадают, хотя и не всегда. Так, при избытке одного из компонентов элементарной реакции А + В (А >> В) скорость реакции будет практически зависеть от изменения концентрации вещества В (А = const), поэтому порядок бимолекулярной реакции понижается до первого. Аналогично тому, что скорость реакции может характеризоваться по любому веществу, участвующему в реакции, для реакции aА + bВ → кинетические уравнения по веществу А и веществу В выглядят соответственно. Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции. Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально. Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции. Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
H2 + I2 = 2HI.
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества. Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции. Например, реакция NO2 + CO = CO2 + NO, при температурах, меньших 298К, протекает по следующему механизму: первая стадия процесса: NO2 + NO2 = NO3 + NO
вторая стадия процесса: NO3 + CO = CO2 + NO2,
причем лимитирующей, т.е. скорость определяющей стадией является первая стадия процесса: NO2 + NO2 = NO3 + NO
Тогда, согласно первому постулату химической кинетики, который утверждает, что скорость всей реакции равна скорости его самой медленной стадии, можно записать: где Согласно второму постулату химической кинетики, который утверждает, что скорость элементарной (одностадийной) реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам, получим зависимость скорости реакции NO2 + CO CO2 + NO от концентрации реагирующих веществ:
Обратите внимание, что скорость реакции NO2 + CO CO2 + NO не зависит от концентрации оксида углерода CO.
4. Уравнения кинетики реакций 1-го, 2-го и нулевого порядка. Период полупревращения.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Реакция нулевого порядка – скорость реакций не зависит от концентраций реагирующих веществ. Кинетическое уравнение имеет следующий вид:
Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Размерность константы скорости нулевого порядка совпадает с размерностью скорости, моль/(л*с).
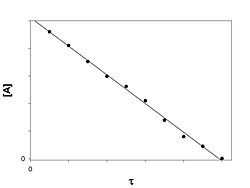
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции. Важной кинетической характеристикой реакции является время полупревращения, или период полупревращения – время, за которое прореагирует половина исходного вещества. Для реакции нулевого порядка =C0/2k.
Реакция первого порядка. Скорость реакции первого порядка прямо пропорциональна концентрации реагирующего вещества. Кинетическое уравнение реакции первого порядка:
Приведение уравнения к линейному виду даёт уравнение: Lh c0 – lh c = kt
График зависимости концентрации реагента A для первого порядка реакции Период полупревращения:
Большинство реакций гидролиза органических соединений протекают как реакции первого порядка.
Реакция второго порядка. Скорость реакции второго порядка прямо пропорциональна произведению концентраций двух реагентов или одного из реагентов во второй степени. Для реакций второго порядка кинетическое уравнение имеет следующий вид: V=k*ca*cb
Период полупревращения (для случая равных начальных концентраций!):
Кинетике второго порядка подчиняются такие простые бимолекулярные реакции, как, щелочной гидролиз сложного эфира.
5. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Уравнение Аррениуса. Энергетические диаграммы экзо- и эндотермических реакций.
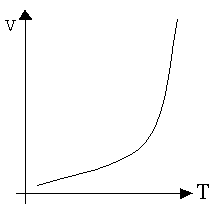
При повышении температуры скорость большинства химических реакций увеличивается, так как увеличивается энергия всех форм движения частиц (поступательная, колебательная, вращательная) и увеличивается число активных частиц. Увеличение скорости с возрастанием температуры весьма значительно. Так, например, скорость реакции 2Н2 + О2 = 2Н2О при 300о неизмеримо мала, а при 700о реакция протекает уже мгновенно, в форме взрыва. Общий характер зависимости скорости химической реакции от температуры приведен на рис. 3.4. Такой тип температурной зависимости скорости реакции называется нормальным. Он характерен практически для всех простых реакций.
Рис. 34. Зависимость скорости химической реакции от температуры
Некоторые реакции замедляются с возрастанием температуры, как это, например, наблюдается в случае ферментативных реакций при высоких температурах. При повышении температуры фермент уменьшает свою каталитическую активность, поэтому скорость реакции тоже уменьшается. Такой тип температурной зависимости скорости реакции называется аномальным. Иногда зависимость скорости реакции от температуры выражают с помощью приближенного эмпирического правила Вант-Гоффа (1884 г.). При повышении температуры на каждые 10о скорость большинства реакций увеличивается примерно в 2¸4 раза
где γ – температурный коэффициент скорости реакции (или температурный коэффициент Вант-Гоффа). Он показывает во сколько раз возрастает скорость (или константа скорости) данной реакции при повышении температуры системы на 10о. Значение γ для большинства реакций лежит в пределах от 2 до 4. Если температура системы повысилась не на 10о, а изменилась с t1 до t2, то уравнения (3.15) в общем виде будут в такой форме:
где Но правило Вант-Гоффа приближенное. Более точную зависимость скорости и константы скорости реакции от температуры выражает уравнение Аррениуса, установленное в 1889 году. lnk = где а и в – постоянные, характерные для данной реакции. Уравнению Аррениуса часто придают другой вид. Вводя обозначения после потенцирования получаем:
где k – константа скорости реакции; А – предэкспоненциальный множитель или предэкспонента, почти не зависящий от температуры; R – универсальная газовая постоянная; Еа – энергия активации реакции; Т – температура в оК. Отметим, что Еа и А – постоянные величины для данной реакции. Зная энергию активации и k1 и Т1, можно определить константу скорости реакции (k2) при любой температуре (Т2) реакции. Из уравнения (3.18) видно, что, чем больше энергия активации, тем меньше k при данной температуре. Кроме того, при данной энергии активации Е наблюдается прямая зависимость между k и Т. Уравнение Аррениуса для скорости реакции записывается в несколько измененной форме:
где Ас – тоже называется предэкспонента, но в отличие от предэкспоненты А в уравнении Аррениуса для константы скорости Ас зависит от концентрации реагирующих веществ.
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1564; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.22.184 (0.013 с.) |


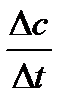 может быть как положительным, так и отрицательным.
может быть как положительным, так и отрицательным. ,
, 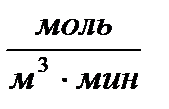 и т.д. Необходимо отметить, что скорость реакции можно определить не только по изменению концентрации вещества в единицу времени, но и по изменению других свойств, например, давления, интенсивности окраски раствора, электропроводности, рН раствора.
и т.д. Необходимо отметить, что скорость реакции можно определить не только по изменению концентрации вещества в единицу времени, но и по изменению других свойств, например, давления, интенсивности окраски раствора, электропроводности, рН раствора. (3.12),
(3.12), (3.13).
(3.13).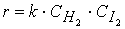
 ,
,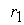 - скорость первой стадии процесса.
- скорость первой стадии процесса.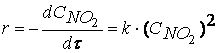






 или
или  , (3.15)
, (3.15) или
или  ,
, .
. - эмпирическое уравнение Аррениуса (Швеция) для константы скорости реакции (3.17),
- эмпирическое уравнение Аррениуса (Швеция) для константы скорости реакции (3.17), , (3.18)
, (3.18) , (3.20)
, (3.20)


