
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция на границе жидкость – газ. Уравнение адсорбции гиббсаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основы термодинамики адсорбции созданы американским физиком-теоретиком Дж. Гиббсом. Рассмотрим равновесную двухфазную систему водный раствор поверхностно-активного вещества – воздух. Поверхностно-активное вещество (ПАВ) – химическое соединение, структура которого включает неполярную углеводородную цепь, например СН3(СН2)nСН2-, соединенную с полярной группой, например такой, как -[О(СН2)2]xOH (рис. 10).
Рис. 10. Структура молекулы поверхностно-активного вещества
Молекулы воды вытесняют некоторую часть поверхностно-активного вещества на границу раздела фаз вода – воздух (газ). Полярные группы остаются в водной (полярной) среде, неполярные – в газовой фазе (неполярной среде). Так, молекулярный слой ПАВ концентрируется на границе раздела фаз. Каждая из фаз однородна, но однородность нарушается в поверхностном слое за счет избытка количества поверхностно-активного вещества (адсорбтива), который концентрируется на границе раздела фаз, внедряясь между молекулами воды. В поверхностном слое изменяется концентрация молекул воды (она уменьшается) и молекул поверхностно-активного вещества (она увеличивается) по сравнению с водным раствором ПАВ (рис. 11).
Рис. 11. Адсорбция (концентрирование) ПАВ на границе раздела фаз жидкость – газ
Внедрение неполярных углеводородных групп между молекулами воды приводит к уменьшению энергии межмолекулярного притяжения в поверхностном слое, что уменьшает поверхностное натяжение s.
Отступление. Гиббсом введена величина Г [моль/м2] (гиббсовская адсорбция), представляющая собою избыток адсорбата в объеме поверхностного слоя толщины Dх по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента. Связь между гиббсовской адсорбцией Г, поверхностным натяжением s и концентрацией адсорбтива с в растворе устанавливается на основании термодинамических расчетов. Функция Гиббса G, отражающая состояние двухфазной системы жидкий раствор – газ, зависит от температуры Т, давления р, площади поверхности раздела фаз s, а также количества адсорбата n 1 (ПАВ) и растворителя n 2: G = f (p, T, s, n 1, n 2),
При постоянной температуре и давлении (р,Т = const) уравнение (2.7) примет вид:
dG = где
dG = dG = d (s s + m 1 n 1 + m 2 n 2), где G = s s + m 1 n 1 + m 2 n 2. Полный дифференциал функции G: dG = s ds + sd s + m 1 dn 1 + n 1 dm 1 + m 1 dn 1 + n 1 dm 1. (2.10) Принимая во внимание уравнение (2.9), получим: sd s + n 1 dm 1 + n 2 dm 2 = 0. (2.11) Уравнение (2.11) отражает энергетическое состояние поверхностного слоя (sd s), а также количества адсорбата n 1 и растворителя n 2 в поверхностном слое. Объемная фаза раствора не зависит от энергетического состояния поверхностного слоя и уравнение (2.11) для объемной фазы имеет вид:
где Из уравнения (2.12) следует
Подставим значение dm 2 в уравнение (2.11), получим:
или
где Из уравнения (2.13) следует:
Для разбавленных растворов:
Подставляя
Графическая зависимость адсорбции Гиббса (Г – избыток адсорбата в поверхностном слое) и поверхностного натяжения s от концентрации адсорбтива представлена на рис. 12. Прямые измерения избытка адсорбата Г [моль/м2] в поверхностном слое – трудная задача. Обычно поступают следующим образом. Экспериментально определяют зависимость поверхностного натяжения s от концентрации адсорбтива с в водном растворе и строят изотерму в координатах s от с (рис. 12). Графически определяют величины
Рис. 12. Изотерма адсорбции Г и поверхностного натяжения s от концентрации адсорбтива при Т = 298 К
Среди способов экспериментального определения поверхностного натяжения s на границе жидкость – газ рассмотрим метод наибольшего давления образования пузырьков на приборе Ребиндера (рис. 13). Поверхностное натяжение рассчитывают по формуле:
Рис. 13. Прибор Ребиндера - вакуумная пробирка с капилляром для определения поверхностного натяжения sж-г
Наряду с поверхностно-активными веществами, уменьшающими поверхностное натяжение на границе раздела фаз, существуют поверхностно-инактивные вещества, увеличивающие поверхностное натяжение. Как правило, это электролиты, соли неорганических кислот. Ионы окружены гидратными оболочками и удерживаются в объеме. Лишь незначительные количества ионов электролита проникают в поверхностный слой. Но и этого количества достаточно для увеличения поверхностного натяжения (рис. 14) на границе раздела газ – жидкость.
Рис. 14. Адсорбция поверхностно-инактивного вещества на границе раздела фаз жидкость – газ
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 660; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.234.202 (0.009 с.) |



 .(2.7)
.(2.7) , (2.8)
, (2.8) - поверхностное натяжение,
- поверхностное натяжение, и
и  - химические потенциалы адсорбтива и воды соответственно.
- химические потенциалы адсорбтива и воды соответственно. , (2.9)
, (2.9) , (2.12)
, (2.12) и
и  количество адсорбтива и растворителя в жидкой фазе.
количество адсорбтива и растворителя в жидкой фазе. .
.
 , (2.13)
, (2.13)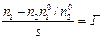 - избыток адсорбата в объеме поверхностного слоя толщиной Dх по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента.
- избыток адсорбата в объеме поверхностного слоя толщиной Dх по сравнению с количеством адсорбтива в таком же объеме жидкой фазы, отнесенный к единице площади поверхности адсорбента. . (2.14)
. (2.14) и
и  .
. в уравнение (2.14), получим фундаментальное адсорбционное уравнение Гиббса:
в уравнение (2.14), получим фундаментальное адсорбционное уравнение Гиббса: . (2.15)
. (2.15) для различных значений с – концентрации ПАВ в растворе и по уравнению
для различных значений с – концентрации ПАВ в растворе и по уравнению  вычисляют значения избытка адсорбата Г на поверхности адсорбента.
вычисляют значения избытка адсорбата Г на поверхности адсорбента.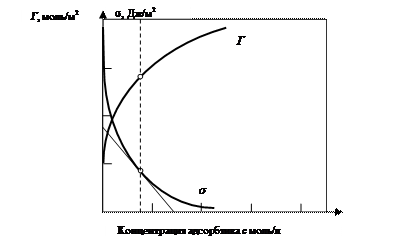
 , где s - поверхностное натяжение водного раствора адсорбтива, концентрация которого с; р – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра; s0 = 71.95×10-3 Дж/м2 - табличное значение поверхностного натяжения воды; р 0 – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра в чистой воде.
, где s - поверхностное натяжение водного раствора адсорбтива, концентрация которого с; р – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра; s0 = 71.95×10-3 Дж/м2 - табличное значение поверхностного натяжения воды; р 0 – давление внутри сосуда, при котором пузырек воздуха отрывается от капилляра в чистой воде.




