Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Причина скачка потенциала на границе раздела фазСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Причина скачка потенциала на границе раздела фаз
Элекрохимический потенциал и равновесие на границе электрод-раствор С другой стороны, где электрохимический потенциал компонента равен μi – его химический потенциал; φα – внутренний электростатический потенциал фазы ziFφα - работа по переносу отрицательного заряда из вакуума в глубь фазы, которая не учитывает неэлектростатические взаимодействия частицы внутри фазы. ¨ Если в электрохимической системе устанавливается равновесие при p, T = const v A A + v B B = v C С + v D D, то для нее Δ G = − zFE, где E – электродвижущая сила (э.д.с.) системы. ¨ Данное уравнение можно применять только для равновесной системы. ¨ zFE – максимальная электрическая работа, которую может совершить электрохимическая система.
3) Составляющие внутреннего потенциала ¨ Внутренний электростатический потенциал фазы φα представляет собой сумму внешнего ψα и поверхностного χα потенциалов: φα = ψα + χα ¨ Внешний потенциал равен изменению потенциала при переносе отрицательного заряда из вакуума к поверхности фазы. ¨ Внешний потенциал обусловлен взаимодействием заряда со свободными зарядами в фазе. Поверхностный потенциал ¨ Поверхностный потенциал (χα) равен изменению потенциала при переносе заряда через границу поверхность среды ¨ Если свободный электростатический заряд равен нулю, то ψα = 0 и, следовательно, φα = χα ¨ Для растворов χα появляется вследствие ориентации диполей молекул растворителя на поверхности. ¨ На границе металл-вакуум χα обусловлен возникновением дипольного момента вследствие частичного смещения электронной плотности относительно ионов кристаллической решетки металла Электроды второго рода Электроды второго рода – системы, у которых значение электродных потенциалов не зависит от активности окисленной и восстановленной формы металла, а определяется активностью анионов, не принимающих участие в окислительно-восстановительных превращениях. Представляет собой металл, покрытый труднорастворимым соединением данного металла и погруженный в раствор, содержащий общий анион с труднорастворимым соединением. Среди электродов второго рода наиболее распространенными являются хлорсеребряный и каломельный электроды, которые применяют в качестве электродов сравнения. Хлорсеребряный (описание – методичка – стр. 47!!!!!!!!!!!)
Каломельный электрод (описание – методичка – стр. 48!!!!!!!!!!!) ½ Hg2Cl2 + e− = Hg + Cl− Cl−|Hg2Cl2|Hg|Pt
Электроды третьего рода
¨ Электроды третьего рода – системы, у которых значение электродного потенциала не зависит от активности окисленной и восстановленной формы, а определяется активностью катиона в растворе AgCl + e− + ½ Pb2+ = Ag + ½ PbCl2 Pb2+|PbCl2|AgCl|Ag
Окислительно-восстановительные электроды (описание – методичка – стр. 49!!!!!!!!!!!) ¨ Окислительно-восстановительные электроды – системы, электродный потенциал которых зависит от активности окисленной и восстановленной форм ионов в растворе Fe3+ + e− = Fe2+ Fe3+,Fe2+|Pt
ГАЗОВЫЕ ЭЛЕКТРОДЫ.
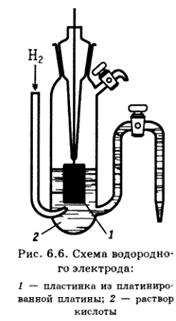
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода: H+ êH2 êPt Электродная реакция: 2Н+ + 2 е = Н2
Потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода: ОН- êО2 êPt Электродная реакция: О2 + 2Н2О + 4 е = 4ОН-
Однако реализовать кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, часть кислорода восстанавливается на электроде не до воды, а до ионов перекиси водорода.
8) Мембранные электроды, Потенциал Доннана, потенциал асимметрии, стеклянный электрод, ионселективные электроды.
• • Как правило, используют цепь Ag|AgCl|KCl(нас.)||H+|стекло|KCl|AgCl|Ag • Для стеклянного электрода
где E ºэл – стандартный потенциал электрода; β – эмпирический параметр • E ºэл и β определяют калибровкой
¨ Механизм действия ¨ Мембрана проницаема для Li+ и Na+, но не H3O+ ¨ Ионы H3O+ модифицируют поверхностный слой на внутренней и внешней поверхности электродов ¨ Степень модификации зависит от активности ионов водорода в растворе ¨ Изменение заряда внешнего слоя передается на внутренний слой с помощью ионов Na+ и Li+, находящихся в стекле
9) Классификация Электрохимических Цепей ¨ По источнику электрической энергии ¤ Физические ¤ Концентрационные ¤ Химические ¨ По наличию или отсутствию в цепи границы между двумя растворами ¤ Цепи с переносом (без границы) ¤ Цепи без переноса
Химические источники тока Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока. Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен. Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы. СВИНЦОВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой элемент: (-) Pb êPbSO4 êH2SO4 (32-34 %) êPbO2 êPb (+) Здесь имеется два электрода второго рода: свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод). При работе аккумулятора протекают следующие электродные реакции: на левом электроде (свинцово-сульфатном) Pb + SO42- на правом электроде (свинцово-диоксидном) PbO2(т)+4H++SO42-+2 e Суммарная реакция в цепи:Pb+PbO2(т)+4H++SO42- Откуда ЭДС цепи равна:Е = Ео + (поскольку Элемент Лекланше В качестве электродов в «сухом элементе» выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют еще угольно — цинковым элементом. Положительным электродом «+» является угольный стержень, отрицательным — цинковый стакан. Угольный стержень окружен смесью диоксида марганца (MnO2) и угля (сажи). В качестве электролита выступает раствор хлорида аммония (NH4Cl) с небольшой добавкой хлорида цинка (ZnCl2) загущенный крахмалом и мукой. Катод: Zn → Zn 2+ + 2e− На угольном стержне электроны расходуются на восстановление H3O+-ионов: Анод: 2MnO2 + 2 H3O++ 2e− → 2MnO(OH) + 2H2O При восстановлении H3O+-ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды: 2MnO2 + 2 H3O+ + 2e− → 2MnO(OH) + 2H2O Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется. В общем: 2NH4Cl + 2H2O ↔ 2NH3 + 2 H3O+ + 2Cl− Образующиеся на катоде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль: Раствор электролита: Zn2+ + 2NH4+ + 2Cl− + 2H2O ↔ [Zn(NH3)2]Cl2 + 2H3O+ Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO(OH) + [Zn(NH3)2]Cl2
2.5) Термодинамика гальванического элемента. Температурный коэффициент ЭДС. Уравнение (правило) Томпсона. Уравнение Тафеля Уже в 1905 г. Тафель эмпирически вывел уравнение, которое связывает перенапряжение с плотностью тока, проходящего через раствор, т.е. со скоростью электрохимического процесса: h = а + b lg i h – перенапряжение, В; a и b – константы; i – плотность тока, А/см2. Смысл величины а: а дает значение перенапряжения при i = 1 А/см2. Величина а существенно зависит от материала электрода. Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса; в большинстве случаев она приблизительно равна 0,116 В при z = 1 и комнатной температуре. Концентрационная поляризация. Концентрационная поляризация обусловлена уменьшением в процессе электролиза концентрации ионов, определяющих потенциал у поверхности электрода; в результате этого изменяется равновесный потенциал электрода. Влиянием концентрационной поляризации на потенциал электрода под током можно пренебречь лишь при малых плотностях тока (т.е при малых скоростях электрохимической реакции). При прохождении тока концентрация ионов металла в непосредственной близости у катода уменьшается, а концентрация их в остальной части раствора остается постоянной. сдвиг потенциала, обусловленный концентрационной поляризацией, будет равен Dj = Величины Dj обоих электродов складываются в ЭДС концентрационной поляризации, направленную против приложенной к электролитической ванне разности потенциалов. • Плотность тока обмена • В состоянии равновесия анодная и катодная плотности тока равны. • Плотность тока в таком состоянии называется плотностью тока обмена j а = j к = j 0 • Если учесть, что Δмр-р φ = E равн + η, то • Получаемое выражение для плотности тока называется уравнением Батлера-Фольмера: Идеально поляризуемый электрод • Идеально поляризуемый электрод – электрод с нулевой плотностью тока обмена (j 0 = 0) • Идеально неполяризуемый электрод – электрод с бесконечно большим током обмена (j 0 → ¥) • Чем больше ток обмена, тем меньше перенапряжение, поэтому в качестве электродов сравнения используются системы с высоким j 0 Низкое перенапряжение • Если zfη << 1, то • Последнее выражение значит, что взаимосвязь между перенапряжением и протекающим током аналогична закону Ома для проводника
Высокое перенапряжение • Если перенапряжение – достаточно большая положительная величина (η > 0.12 В), то можно пренебречь катодным током и учитывать только анодный процесс • Прологарифмируем выражение: • Если перенапряжение – большая отрицательная величина, то, рассуждая аналогично, можно получить
Поляризационные кривые
Пассивность металлов • Состояние повышенной коррозионной устойчивости металлов в таких условиях, когда термодинамически возможно их взаимодействие с веществами, находящимися в окружающей среде, называется пассивным. • Примеры: Fe в H2SO4(конц.), Al на воздухе, Ni в щелочных растворах. • Пассивность металлов связана с образованием на их поверхности защитных пленок в результате образования малорастворимых химических соединений или адсорбции веществ. Способы защиты • Повышение коррозионной стойкости самого материала путем нанесения химической модификации или нанесения химических покрытий • Снижение агрессивности коррозионной среды, в первую очередь, путем удаления O2, CO2 и введения ингибиторов. • Нанесение изолирующих покрытий – лакокрасочных, полимерных, конверсионных (оксидов, фосфатов, хроматов). • Регулирование электродного потенциала защищаемого материала • Катодная защита – отрицательный потенциал накладывается на защищаемый материал за счет внешнего источника тока или создания цепи с более электроотрицательного металла • Анодная защита применяется к металлам, которые пассивируются при их поляризации внешним анодным током.
Граница электрод-раствор • При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве. • Говорят, что образовался двойной электрический слой (д.э.с.) • Образование двойного электрического слоя может быть вызвано разными причинами: – Смещением электронной плотности металла на границе – Адсорбцией ионов противоположного знака – Ориентацией молекул растворителя вблизи поверхности электрода – Специфической адсорбцией неэлектролитов из раствора • Разделение зарядов приводит к возникновению разности потенциалов между металлом и раствором (гальвани-потенциал)
7.1) Электрические и адсорбционные явления на границе раздела фаз. Уравнение Гиббса. Поверхностное натяжение (обратимая поверхностная работа). Двойной электрический слой.
• • Говорят, что образовался двойной электрический слой (д.э.с.) • Образование двойного электрического слоя может быть вызвано разными причинами: – Смещением электронной плотности металла на границе – Адсорбцией ионов противоположного знака – Ориентацией молекул растворителя вблизи поверхности электрода – Специфической адсорбцией неэлектролитов из раствора • Разделение зарядов приводит к возникновению разности потенциалов между металлом и раствором (гальвани-потенциал)
7.2) Электрокапиллярные явления, капиллярный электрометр. Уравнение липпмана.
7.3) двойной электрический слой. Его емкость. Импеданс.
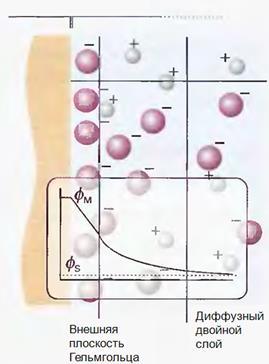
7.4) Модели строения двойного электрического слоя. Теория гельмгольца, Гуи-Чепмена, Штерна. Современные представления Модель Гельмгольца • • Электрический потенциал линейно изменяется с расстоянием • Тепловое движение ионов, приводящее к их разупорядоченности, не рассматривается
• Двойной электрический слой рассматривается аналогично ионной атмосфере иона в теории Дебая-Хюккеля (1-е приближение) • Электрический потенциал изменяется нелинейно с расстоянием • Упорядочение в д.э.с. недооценивается
Модель Штерна • Сочетает преимущества обоих подходов • Вблизи электрода расположение ионов упорядочено, как в модели Гельмгольца • На больших расстояниях расположение молекул рассматривается аналогично 2-му приближению теории Дебая-Хюккеля
Модель Грэма • Представляет собой развитие модели Штерна • К внешней плоскости Гельмгольца добавлена внутренняя плоскость Гельмгольца, которая представляет собой слой несольватированных противоионов, химически связанных с поверхностью электрода
ДАЛЬНЕЙШЕЕ РАЗВИТИЕ ТЕОРИИ СТОЕНИЯ ДЭС. Было предпринято много попыток разработать теорию ДЭС, количественно согласующуюся с опытными данными (Райс, Фрумкин с сотр., Бокрис, Деванатхан, Есин, Мюллер, Парсонс, Эршлер и др.). Наибольшее признание получила модель Грэма (1947). Согласно Грэму, обкладка ДЭС, находящаяся в растворе, состоит не из двух, а из трех частей. Первая, считая от поверхности металла, называется внутренней плоскостью Гельмгольца; в ней находятся лишь поверхностно-активные ионы (заряд плоскости равен q1) либо, если их нет в растворе, молекулы растворителя (q1 = 0); потенциал ее, отнесенный к раствору, обозначается y1. Следующая, удаленная от поверхности металла на расстояние, до которого могут подходить ионы (центры их заряда), называется внешней плоскостью Гельмгольца; ее общий заряд равен q2, а потенциал плоскости y2. За внешней плоскостью Гельмгольца располагается диффузный слой с потенциалом, изменяющимся от y2 до нуля и с плотностью заряда, совпадающей с q2.
Причина скачка потенциала на границе раздела фаз
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1495; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.49.90 (0.011 с.) |


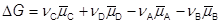
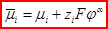




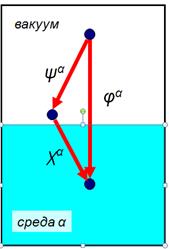 Внутренний, поверхностный и внешний потенциалы, гальвани и вольта потенциалы.
Внутренний, поверхностный и внешний потенциалы, гальвани и вольта потенциалы.



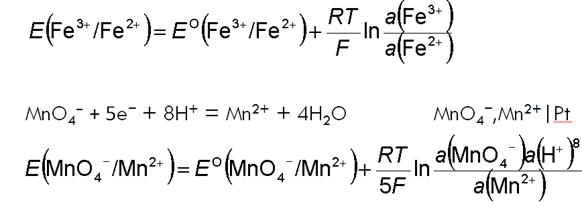
 Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина).
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). =
=  + 2,303
+ 2,303  lg
lg  = 2,303
= 2,303 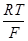 lg
lg  - 2,303
- 2,303 
 =
=  + 2,303
+ 2,303  lg
lg  =
= 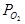 - 2,303
- 2,303 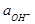




 Стеклянный электрод
Стеклянный электрод Для измерения pH растворов можно использовать газовый водородный электрод, но на практике для этого обычно используют стеклянный электрод
Для измерения pH растворов можно использовать газовый водородный электрод, но на практике для этого обычно используют стеклянный электрод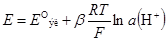




 PbSO4 (т) + 2 е
PbSO4 (т) + 2 е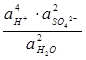 = Ео +
= Ео + 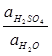
 - общей активности серной кислоты)
- общей активности серной кислоты) ln
ln 

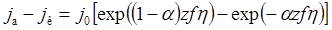








 При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.
При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.









 Сольватированные противоионы прилегают к поверхности металла
Сольватированные противоионы прилегают к поверхности металла Модель Гуи-Чепмена
Модель Гуи-Чепмена