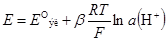Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальвани-потенциал и вольта-потенциалСодержание книги Поиск на нашем сайте ¨ Разность внутренних потенциалов двух фаз называют гальвани-потенциалом ¨ ¨ Величину гальвани-потенциала невозможно определить в эксперименте ¨ Разность внешних потенциалов двух фаз называют вольта-потенциалом ¨
Гальванипотенциал нельзя измерить экспериментально, вольта – можно. ЭДС правильно разомкнутой цепи можно представить как минимум 3-мя гальванипотенциалами.
4) Равновесие в электрохимической цепи, электродный потенциал.
¨ Участники электрохимических процессов разделены в пространстве, поэтому общий процесс можно разделить на две полуреакции. ¨ Соответственно, э.д.с. системы можно представить в виде суммы двух электродных потенциалов: E = φ1 + φ2 E º = φº1 + φº2 ¨ Для полуреакции на каждом электроде можно записать уравнение Нернста ¨ В общем случае можно определить только сумму электродных потенциалов, но не их абсолютное значение.
5) ЭДС равновесной электрохимической цепи, правильноразомкнутая электрохимическая цепь, закон вольта. Потенциал нулевого заряда
ПОТЕНЦИАЛ НУЛЕВОГО ЗАРЯДА (ПНЗ), потенциал электрода, заряд пов-сти к-рого Q равен нулю. При этом величина Q определяется как кол-во электричества, к-рое необходимо сообщить электроду при увеличении площади его пов-сти на единицу для того, чтобы потенциал электрода Е оставался постоянным.
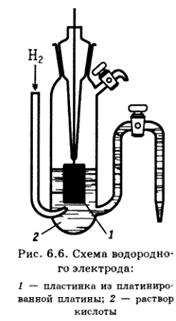
6) Окислительно-восстановительные полуреакции, электродный потенциал, стандартный электродный потенциал, правила записи электродов
¨ Правила записи электродов ¨ В электродной полуреакции слева записывают окисленную форму, а справа – восстановленную. ¨ Вертикальная линия (|) обозначает границу раздела фаз, двойная вертикальная линия (||) – границу между растворами с устраненным диффузионным потенциалом, прерывистая вертикальная линия () – границу между растворами с диффузионным потенциалом. ¨ В электрохимической цепи левый электрод включается в обратном направлении, а правый – в прямом. ¨ Э.д.с. цепи равна E = E п – E л
7) Классификация электродов: первого, второго, третьего рода, сравнения: водородный, хлорсеребряный, каломельный. Окислительно-восстановительные и газовые Классификация электродов ¨ Электроды первого рода ¤ Металлические ¤ Газовые ¤ Амальгамные ¨ Электроды второго рода ¨ Электроды третьего рода ¨ Окислительно-восстановительные электроды ¨ Ион-селективные электроды ¤ Стеклянные электроды ¤ Электроды с полимерными мембранами ¤ Ферментные электроды и т.д. Электроды первого рода Электроды первого рода – системы, у которых значение электродных потенциалов зависит от активности окисленной (или восстановленной) формы, обратимые относительно катиона или аниона Металлические электроды Zn2+ + 2e − = Zn Zn2+|Zn Газовые электроды H+(р-р) + e − = ½ H2(г) H+|H2|Pt ¨ Электроды первого рода ¤ Газовые электроды ½ Cl2(г) + e − = Cl − Cl − |Cl2|Pt ¤ Амальгамные электроды Tl+ + e − = Tl(Hg) Tl+|Tl(Hg)|Pt Электроды второго рода Электроды второго рода – системы, у которых значение электродных потенциалов не зависит от активности окисленной и восстановленной формы металла, а определяется активностью анионов, не принимающих участие в окислительно-восстановительных превращениях. Представляет собой металл, покрытый труднорастворимым соединением данного металла и погруженный в раствор, содержащий общий анион с труднорастворимым соединением. Среди электродов второго рода наиболее распространенными являются хлорсеребряный и каломельный электроды, которые применяют в качестве электродов сравнения. Хлорсеребряный (описание – методичка – стр. 47!!!!!!!!!!!)
Каломельный электрод (описание – методичка – стр. 48!!!!!!!!!!!) ½ Hg2Cl2 + e− = Hg + Cl− Cl−|Hg2Cl2|Hg|Pt
Электроды третьего рода
¨ Электроды третьего рода – системы, у которых значение электродного потенциала не зависит от активности окисленной и восстановленной формы, а определяется активностью катиона в растворе AgCl + e− + ½ Pb2+ = Ag + ½ PbCl2 Pb2+|PbCl2|AgCl|Ag
Окислительно-восстановительные электроды (описание – методичка – стр. 49!!!!!!!!!!!) ¨ Окислительно-восстановительные электроды – системы, электродный потенциал которых зависит от активности окисленной и восстановленной форм ионов в растворе Fe3+ + e− = Fe2+ Fe3+,Fe2+|Pt
ГАЗОВЫЕ ЭЛЕКТРОДЫ.
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода: H+ êH2 êPt Электродная реакция: 2Н+ + 2 е = Н2
Потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода: ОН- êО2 êPt Электродная реакция: О2 + 2Н2О + 4 е = 4ОН-
Однако реализовать кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, часть кислорода восстанавливается на электроде не до воды, а до ионов перекиси водорода.
8) Мембранные электроды, Потенциал Доннана, потенциал асимметрии, стеклянный электрод, ионселективные электроды.
• • Как правило, используют цепь Ag|AgCl|KCl(нас.)||H+|стекло|KCl|AgCl|Ag • Для стеклянного электрода
где E ºэл – стандартный потенциал электрода; β – эмпирический параметр • E ºэл и β определяют калибровкой
¨ Механизм действия ¨ Мембрана проницаема для Li+ и Na+, но не H3O+ ¨ Ионы H3O+ модифицируют поверхностный слой на внутренней и внешней поверхности электродов ¨ Степень модификации зависит от активности ионов водорода в растворе ¨ Изменение заряда внешнего слоя передается на внутренний слой с помощью ионов Na+ и Li+, находящихся в стекле
9) Классификация Электрохимических Цепей ¨ По источнику электрической энергии ¤ Физические ¤ Концентрационные ¤ Химические ¨ По наличию или отсутствию в цепи границы между двумя растворами ¤ Цепи с переносом (без границы) ¤ Цепи без переноса
|
||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 976; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.006 с.) |

























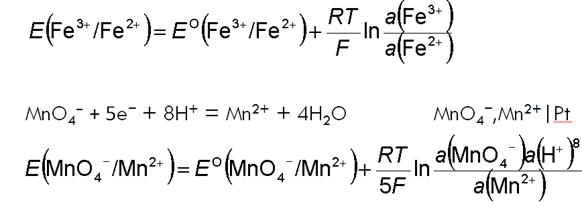
 Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина).
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). =
=  + 2,303
+ 2,303  lg
lg  = 2,303
= 2,303 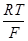 lg
lg  - 2,303
- 2,303 
 =
=  + 2,303
+ 2,303  lg
lg  =
= 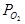 - 2,303
- 2,303 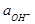




 Стеклянный электрод
Стеклянный электрод Для измерения pH растворов можно использовать газовый водородный электрод, но на практике для этого обычно используют стеклянный электрод
Для измерения pH растворов можно использовать газовый водородный электрод, но на практике для этого обычно используют стеклянный электрод