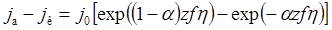Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы. Эдс.Содержание книги Поиск на нашем сайте
Электрохимическим (или гальваническим) элементом называется устройство для получения электрического тока за счет электрохимических реакций. Простейший электрохимический элемент состоит из двух металлических электродов (проводников первого рода), опущенных в электролит (проводник второго рода) и соединенных между собой металлическим контактом. Несколько электрохимических элементов, соединенных последовательно, образуют электрохимическую цепь. ¨ Если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же реакция, но в противоположных направлениях, то такие электроды, а также элемент или цепь, составленные из них, называются обратимыми. ЭДС обратимых элементов является их термодинамическим свойством, т.е. зависит только от Т,Р, природы веществ, составляющих электроды и растворы, и концентрации этих растворов ¨ Если в электрохимической системе устанавливается равновесие при p, T = const v A A + v B B = v C С + v D D, то для нее Δ G = − zFE, где E – электродвижущая сила (э.д.с.) системы. ¨ Данное уравнение можно применять только для равновесной системы. ¨ zFE – максимальная электрическая работа, которую может совершить электрохимическая система. ¨ Применим уравнение Гиббса-Гельмгольца к электрохимической системе ¨ Если вспомнить, что ¨ ¨ Температурный коэффициент э.д.с. характеризует энтропию химической реакции DH = DG - T 1. Если dE/dT > 0, то nFE > 2. Если dE/dT < 0, то nFE < 3. Если dE/dT = 0, то DG = DH и nFE = 3.5) Потенциометрия. Потенциометрия (от лат. potentia-сила, мощность и греч. metreo- измеряю), электрохимический метод исследования и анализа веществ, основанный на зависимости равновесного электродного потенциала Е от термодинамической активности а компонентов электрохимической реакции: nAA + nBB +... ± nF Û nLL + nMM Эта зависимость описывается Нернста уравнением.
При потенциометрических измерениях составляют гальванический элемент с индикаторным электродом, потенциал которого зависит от активности хотя бы одного из компонентов электрохимической реакции, и электродом сравнения и измеряют электродвижущую силу (эдс) этого элемента. В потенциометрии используют гальванические элементы без переноса, когда оба электрода помещают в один и тот же исследуемый раствор, и с переносом, когда электроды находятся в разных растворах, имеющих между собой электролитический контакт. Последний осуществляют таким образом, что растворы могут смешиваться друг с другом только путем диффузии. Элементы без переноса используют в осн. для измерения констант равновесия хим. реакций, констант диссоциации электролитов. констант устойчивости комплексных соединений, произведений растворимости, стандартных электродных потенциалов, а также активностей и коэффициентов активности ионов. Элементы с переносом используют для определения "кажущихся" констант равновесия (поскольку при этом не учитывают жидкостной потенциал), активностей и коэффициентов активности ионов, а также в потенциометрических методах анализа. Среди этих методов различают прямую потенциометрию и потенциометрическое титрование. Прямая потенциометрия применяется для непосредственного определения а ионов (например, Ag+ в растворе AgNO3) по значению Е соответствующего индикаторного электрода (например, серебряного); при этом электродный процесс должен быть обратимым. Более распространены методы потенциометрического титрования, с помощью которых определяют широкий круг веществ в водных и неводных средах. В этих методах регистрируют изменение потенциала индикаторного электрода в процессе титрования исследуемого раствора стандартным раствором реагента в зависимости от объема последнего.
4.5) применение метода измерения ЭДС гальванических элементов: При работе гальванического элемента химическая энергия частично или полностью переходит в электрическую работу. Получаемая работа А при Т, Р=const будет максимально полезной при обратимой работе элемента. Работа равна ΔG=-zFE. Из уравнения Гиббса-Гельмгольца: ΔG=ΔH +T(d ΔG/dT) следует:
A= -ΔH+ZFE(dE/dT). При экспериментальном измерении Е, а также dE/dT (построив график зависимости Е от Т, температурный коэффициент будет равен тангенсу угла наклона прямой) можно найти ΔH=ZF(T dE/dT – E), ΔS=ZF dE/dT. То есть можно определить термодинамические параметры рекции. Для определения ПР, гальванический элемент должен включать в себя электрод второго рода с труднорастворимым соединением, для которого определяется ПР. Рассм на примере концентрационной цепи (-)Ag,AgX|KX,(C1=0,1H)||AgNO3,(C2=0,1|Ag(+). E=φ2-φ1. E=(RT/F)*lnC2/C1. ПР=C(Ag+)*C(X-). Тогда для ЭДС гальванического элемента E=(RT/F)ln(C2*Cx/ПР). Измерив Е и зная С2 и Сх можно рассчитать ПР. Для определения рН р-ра гальванический элемент должен включать электрод, потенциал которого зависит от активности ионов Н+. К таким относятся водородный,хингидронный, кислородный, стеклянный. Например, для хингидронного Pt,Hg,Hg2Cl2/KCl(0,1H)/исслед р-р +хингидрон/Pt. Е= φхг – 0,059рН – φкал.Отсюда находим рН. Для определения средних ионных аkтивностей и коэффициентов активности используют цепи без переноса с электродами первого и второго рода. Для определения чисел переноса используют концентрационные цепи.1.Для цепей с потенциалопределяющими катионами, однозаряженный электролит: Е=2t_(RT/F)ln(a2/a1).2. Для цепей, образованных электродами, потенциалы которых определяются активностью анионов E=(2t+)*(RT/F)ln(a1/a2).
1.6) Основы электрохимической кинетики. Раздел электрохимии, рассматривающий неравновесные, главным образом стационарные процессы, протекающие на электродах во времени, называется кинетикой электрохимических (электродных) процессов или просто электрохимической кинетикой. специфичность электрохимических процессов: 1. Самопроизвольные реакции всегда сопровождаются уменьшением свободной энергии; электрохимическим же путем можно проводить реакции, сопровождающиеся увеличением свободной энергии, т.е. возможности электросинтеза шире, чем возможности обычного химического синтеза. Необходимая свободная энергия доставляется системе извне в виде энергии электрического тока. 2. Суммарную скорость электрохимического процесса можно определить по величине силы тока, протекающего в цепи и регулировать путем изменения силы тока. 3. Скорость электрохимического процесса зависит от ЭДС и существенно зависит от условий диффузии ионов. 4. Энергия активации электрохимического процесса часто связана с падением потенциала в ДЭС Рассмотрим один электрод Предположим, что реакции окисления и восстановления имеют первый порядок Тогда скорость реакции катодного восстановления равна v к = k к[Ox] Скорость реакции анодного окисления равна v а = k а[Red] Для гетерогенных реакции скорость рассчитывают на единицу площади электрода. Размерность констант скорости – длина´время - 1 Сила тока связана со скоростью электродной реакции соотношением I = v | z|FS где | z | - число электронов, участвующих в реакции, S – площадь поверхности электрода Обычно для характеристики скорости электродной реакции используют пропорциональную ей плотность тока:
Предположим, что в лимитирующей стадии электродных процессов переносится z электронов
Тогда для реакции восстановления Ox + z e – = Red j к = zFk к[Ox] для реакции окисления Red = Ox + z e – j а = zFk а[Red] Общая плотность тока равна j = j а – j к = zFk а[Red] – zFk к[Ox] Если j а > j к, то j > 0 и ток называется анодным. Суммарный процесс – окисление. Если j к > j а, то j < 0 и ток называется катодным. Суммарный процесс – восстановление. Стадии электродных процессов 1. Транспорт реагентов из объема электролита к поверхности электродов 2. Электрохимическая реакция – разряд или ионизация, связанная с переходом заряженных частиц через границу раздела электрод – электролит 3. Фазовые превращения – образование или разрушение кристаллической решетки, выделение газов 4. Химические реакции, протекающие до или после электрохимической реакции • Стадии 1 и 2 характерны для всех процессов, 3 и 4 – только для некоторых процессов
2.6) Электродное перенапряжение. Уравнение Таффеля. Концентрационная поляризация. Плотность тока обмена Идеально поляризуемый электрод Низкое перенапряжение Высокое перенапряжение Электродное перенапряжение: • При конечной скорости электрохимической реакции наблюдается отклонение напряжения системы от равновесного значения • Электролиз будет протекать при более высоком напряжении, чем можно рассчитать по уравнению Нернста для равновесной системы • Напряжение на гальваническом элементе будет меньше, чем его равновесное значение • Одной из причин этого является электрическое сопротивление раствора электролита и электродов • Второй и, зачастую, главной причиной является электродное перенапряжение • Разность потенциала электрода под током и равновесного потенциала называют электродным перенапряжением η = E – E равн • Любая из перечисленных выше стадий может лимитировать скорость всего процесса и перенапряжение равно сумме соответствующих вкладов (диффузионного η д, электрохимического η э, фазового η ф и реакционного η р) η = η д + η э + η ф + η р бывает: 1) Электрохимическое (lim перенос заряда) 2) Диффузионное (lim доставка) 3) Химическое 4) Фазовое (lim образование новой фазы) Уравнение Тафеля Уже в 1905 г. Тафель эмпирически вывел уравнение, которое связывает перенапряжение с плотностью тока, проходящего через раствор, т.е. со скоростью электрохимического процесса: h = а + b lg i h – перенапряжение, В; a и b – константы; i – плотность тока, А/см2. Смысл величины а: а дает значение перенапряжения при i = 1 А/см2. Величина а существенно зависит от материала электрода.
Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса; в большинстве случаев она приблизительно равна 0,116 В при z = 1 и комнатной температуре. Концентрационная поляризация. Концентрационная поляризация обусловлена уменьшением в процессе электролиза концентрации ионов, определяющих потенциал у поверхности электрода; в результате этого изменяется равновесный потенциал электрода. Влиянием концентрационной поляризации на потенциал электрода под током можно пренебречь лишь при малых плотностях тока (т.е при малых скоростях электрохимической реакции). При прохождении тока концентрация ионов металла в непосредственной близости у катода уменьшается, а концентрация их в остальной части раствора остается постоянной. сдвиг потенциала, обусловленный концентрационной поляризацией, будет равен Dj = Величины Dj обоих электродов складываются в ЭДС концентрационной поляризации, направленную против приложенной к электролитической ванне разности потенциалов. • Плотность тока обмена • В состоянии равновесия анодная и катодная плотности тока равны. • Плотность тока в таком состоянии называется плотностью тока обмена j а = j к = j 0 • Если учесть, что Δмр-р φ = E равн + η, то • Получаемое выражение для плотности тока называется уравнением Батлера-Фольмера: Идеально поляризуемый электрод • Идеально поляризуемый электрод – электрод с нулевой плотностью тока обмена (j 0 = 0) • Идеально неполяризуемый электрод – электрод с бесконечно большим током обмена (j 0 → ¥) • Чем больше ток обмена, тем меньше перенапряжение, поэтому в качестве электродов сравнения используются системы с высоким j 0 Низкое перенапряжение • Если zfη << 1, то • Последнее выражение значит, что взаимосвязь между перенапряжением и протекающим током аналогична закону Ома для проводника
Высокое перенапряжение • Если перенапряжение – достаточно большая положительная величина (η > 0.12 В), то можно пренебречь катодным током и учитывать только анодный процесс • Прологарифмируем выражение: • Если перенапряжение – большая отрицательная величина, то, рассуждая аналогично, можно получить
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 894; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.234.68 (0.008 с.) |

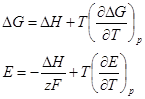
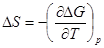 , тогда
, тогда 
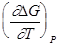 = -nFEP + TnF
= -nFEP + TnF 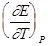
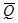 (DG > DH) и система будет превращать в электрическую энергию не только то количество теплоты, которое соответствует тепловому эффекту реакции, но и дополнительную теплоту - теплоту Пелетье QП = nFT dE/dT, заимствуемую из окружающей среды. В адиабатических условиях Т системы понижается (реакция эндотермична).
(DG > DH) и система будет превращать в электрическую энергию не только то количество теплоты, которое соответствует тепловому эффекту реакции, но и дополнительную теплоту - теплоту Пелетье QП = nFT dE/dT, заимствуемую из окружающей среды. В адиабатических условиях Т системы понижается (реакция эндотермична).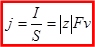
 ln
ln