Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимическая коррозия и способы защиты металлов от коррозии.Содержание книги
Поиск на нашем сайте
• Коррозия – самопроизвольное разрушение металлов и сплавов под действием окружающей среды. • Коррозия наносит большой экономический ущерб в результате безвозвратных потерь металла, преждевременного выхода и строя оборудования и т.д. Классификация: • Химическая коррозия – заключается в протекании химической реакции между металлами и сухими агрессивными газами, а также неэлектролитами. • Электрохимическая коррозия – обусловлена протеканием электрохимических процессов. Встречается наиболее часто в водоемах, почве, влажной атмосфере. • Биохимическая коррозия – вызвана жизнедеятельностью живых организмов. Сочетается с другими видами коррозии. Водородная и кислородная деполяризация • Коррозия связана с протеканием катодных реакций восстановления водорода или кислорода. • В кислой среде при ограниченном доступе кислорода имеет место коррозия с выделением водорода, или коррозия с водородной деполяризацией: H+ + e- = ½ H2 • При значительном доступе кислорода протекает коррозия с поглощением кислорода, или коррозия с кислородной деполяризацией: O2 + 2H2O + 4e- = 4OH- Пассивность металлов • Состояние повышенной коррозионной устойчивости металлов в таких условиях, когда термодинамически возможно их взаимодействие с веществами, находящимися в окружающей среде, называется пассивным. • Примеры: Fe в H2SO4(конц.), Al на воздухе, Ni в щелочных растворах. • Пассивность металлов связана с образованием на их поверхности защитных пленок в результате образования малорастворимых химических соединений или адсорбции веществ. Способы защиты • Повышение коррозионной стойкости самого материала путем нанесения химической модификации или нанесения химических покрытий • Снижение агрессивности коррозионной среды, в первую очередь, путем удаления O2, CO2 и введения ингибиторов. • Нанесение изолирующих покрытий – лакокрасочных, полимерных, конверсионных (оксидов, фосфатов, хроматов). • Регулирование электродного потенциала защищаемого материала • Катодная защита – отрицательный потенциал накладывается на защищаемый материал за счет внешнего источника тока или создания цепи с более электроотрицательного металла • Анодная защита применяется к металлам, которые пассивируются при их поляризации внешним анодным током.
Электрические и адсорбционные явления на границе раздела фаз. Двойной электрический слой. • Детальное знание факторов, влияющих на скорость переноса электронов на электродах помогает лучше понять процесс получения электроэнергии в гальванических элементах, электропроводность металлов, полупроводников и электронных приборов микро- и нанометрового размера. • Эффективность используемых в настоящее время технологий может быть существенно улучшена при – совершенствовании методов производства электроэнергии – разработке новых методов защиты от коррозии • Оба этих направления развития требуют знаний о кинетике электродных процессов Граница электрод-раствор • При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве. • Говорят, что образовался двойной электрический слой (д.э.с.) • Образование двойного электрического слоя может быть вызвано разными причинами: – Смещением электронной плотности металла на границе – Адсорбцией ионов противоположного знака – Ориентацией молекул растворителя вблизи поверхности электрода – Специфической адсорбцией неэлектролитов из раствора • Разделение зарядов приводит к возникновению разности потенциалов между металлом и раствором (гальвани-потенциал)
7.1) Электрические и адсорбционные явления на границе раздела фаз. Уравнение Гиббса. Поверхностное натяжение (обратимая поверхностная работа). Двойной электрический слой.
• • Говорят, что образовался двойной электрический слой (д.э.с.) • Образование двойного электрического слоя может быть вызвано разными причинами: – Смещением электронной плотности металла на границе – Адсорбцией ионов противоположного знака – Ориентацией молекул растворителя вблизи поверхности электрода – Специфической адсорбцией неэлектролитов из раствора • Разделение зарядов приводит к возникновению разности потенциалов между металлом и раствором (гальвани-потенциал)
7.2) Электрокапиллярные явления, капиллярный электрометр. Уравнение липпмана.
7.3) двойной электрический слой. Его емкость. Импеданс.
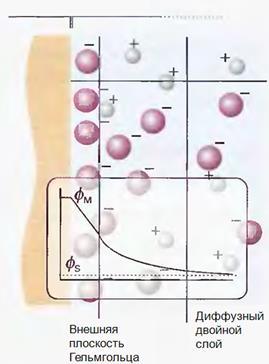
7.4) Модели строения двойного электрического слоя. Теория гельмгольца, Гуи-Чепмена, Штерна. Современные представления Модель Гельмгольца • • Электрический потенциал линейно изменяется с расстоянием • Тепловое движение ионов, приводящее к их разупорядоченности, не рассматривается
• Двойной электрический слой рассматривается аналогично ионной атмосфере иона в теории Дебая-Хюккеля (1-е приближение) • Электрический потенциал изменяется нелинейно с расстоянием • Упорядочение в д.э.с. недооценивается
Модель Штерна • Сочетает преимущества обоих подходов • Вблизи электрода расположение ионов упорядочено, как в модели Гельмгольца • На больших расстояниях расположение молекул рассматривается аналогично 2-му приближению теории Дебая-Хюккеля
Модель Грэма • Представляет собой развитие модели Штерна • К внешней плоскости Гельмгольца добавлена внутренняя плоскость Гельмгольца, которая представляет собой слой несольватированных противоионов, химически связанных с поверхностью электрода
ДАЛЬНЕЙШЕЕ РАЗВИТИЕ ТЕОРИИ СТОЕНИЯ ДЭС. Было предпринято много попыток разработать теорию ДЭС, количественно согласующуюся с опытными данными (Райс, Фрумкин с сотр., Бокрис, Деванатхан, Есин, Мюллер, Парсонс, Эршлер и др.). Наибольшее признание получила модель Грэма (1947). Согласно Грэму, обкладка ДЭС, находящаяся в растворе, состоит не из двух, а из трех частей. Первая, считая от поверхности металла, называется внутренней плоскостью Гельмгольца; в ней находятся лишь поверхностно-активные ионы (заряд плоскости равен q1) либо, если их нет в растворе, молекулы растворителя (q1 = 0); потенциал ее, отнесенный к раствору, обозначается y1. Следующая, удаленная от поверхности металла на расстояние, до которого могут подходить ионы (центры их заряда), называется внешней плоскостью Гельмгольца; ее общий заряд равен q2, а потенциал плоскости y2. За внешней плоскостью Гельмгольца располагается диффузный слой с потенциалом, изменяющимся от y2 до нуля и с плотностью заряда, совпадающей с q2.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.144.139 (0.007 с.) |



 При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.
При погружении металла в раствор на их границе устанавливается равновесие, в результате чего возникает разделение зарядов в пространстве.









 Сольватированные противоионы прилегают к поверхности металла
Сольватированные противоионы прилегают к поверхности металла Модель Гуи-Чепмена
Модель Гуи-Чепмена