
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические цепи (гравитационные, аллотропические).Содержание книги
Поиск на нашем сайте
• Источник электрической энергии – различное физическое состояние одинаковых по химическому составу электродов • Электроды погружены в один и тот же раствор (цепи без переноса) • Различают – Аллотропические цепи – электроды сделаны из одного и того же металла в различных кристаллических модификациях (Mα|MA|Mβ) Е=-дельта G\nF (энергия гиббса перехода метастабильной модификации в стабильную) – Гравитационные цепи – два жидких электрода разной высоты из одного и того же металла погружены в один раствор (Hg|Hg2I2,KI|Hg). Более высокий электрод будет растворяться.
ФИЗИЧЕСКИЕ ЦЕПИ. ГРАВИТАЦИОННЫЕ ЦЕПИ. Такие цепи состоят обычно из двух жидких электродов разной высоты, изготовленных из одного и того же металла. Электроды погружены в раствор соли данного металла. Подобную цепь с ртутными электродами высотой h1 и h2 (h1 > h2), опущенными в раствор соли ртути HgA, можно представить следующей схемой: Hg(h1) êHgA êHg(h2) Электрод большей высоты (h1) обладает повышенным запасом свободной энергии по сравнению с электродом менее высоким, поэтому он растворяется с образованием ионов ртути: Hg (h1) ® 1/2 Hg22+ + e тогда как на правом электроде, с меньшим запасом энергии, ионы ртути разряжаются и выделяется металлическая ртуть: 1/2 Hg22+ + e ® Hg (h2) Суммарный процесс в гравитационной цепи состоит, следовательно, в переносе ртути от высокого электрода к низкому: Hg (h1) ® Hg (h2) АЛЛОТРОПИЧЕСКИЕ ЦЕПИ. Электродами служат две модификации одного и того же металла (Мa и Мb), погруженного в раствор или расплав его ионопроводящего соединения. При данной Т только одна из модификаций устойчива, другая находится в метастабильном состоянии. Электрод, изготовленный из металла в метастабильном состоянии (пусть это будет Мb), обладает повышенным запасом свободной энергии. Он играет роль отрицательного электрода элемента и посылает ионы металла в раствор: Мb = Мn+ + n e На электроде, изготовленном из устойчивой a-модификации, происходит разряд металлических ионов: Мn+ + n e = Мa Т.о., общая реакция в аллотропической цепи Мb êМА êМa заключается в переносе металла от метастабильной модификации к устойчивой:
11) Концентрационные цепи первого и второго рода. Цепи с переносом и без переноса. ¨ Оба электрода идентичны по физическому состоянию и по химической природе; они отличаются только содержанием компонентов (концентрацией ионов, давлением газов и т.п.) Cu|Cu2+(a 1)||Cu2+(a 2)|Cu
¨ Концентрационные цепи с диффузионным потенциалом могут быть использованы для определения чисел переноса КОНЦЕНТРАЦИОННЫЕ ЦЕПИ. КОНЦЕНТРАЦИОННЫЕ ЦЕПИ ПЕРВОГО РОДА. К концентрационным цепям первого рода относят системы, состоящие из двух электродов, одинаковых по своей природе, но отличающихся по количественному составу; оба электрода погружены в один и тот же раствор. Типичным примером концентрационных цепей являются амальгамные цепи, в которых отличие между электродами сводится лишь к неодинаковой активности металла, растворенного в амальгаме:Hg, M(a I) êMA êM(a II), Hg ЭДС такой системы равна: Е = Перенос происходит до тех пор, пока сохраняется различие в концентрациях (активностях) амальгам, использованных в качестве электродов. Другим примером концентрационных цепей первого рода служат простые газовые цепи, составленные из двух одинаковых газовых электродов, отличающихся лишь давлением газа. ЭДС таких систем можно найти из механической работы, совершаемой при переходе 1 моля газа от высокого давления р ¢ к низкому р ¢¢ Е = КОНЦЕНТРАЦИОННЫЕ ЦЕПИ ВТОРОГО РОДА. Эти цепи включают в себя два одинаковых электрода, погруженных в растворы одного и того же электролита различной активности. В зависимости от того, по отношению к каким ионам электролита обратимы электроды, концентрационные цепи второго рода разделяются на катионные, например: Hg, K êKCl(a I)¦KCl(a II) êK, Hg и на анионные, например: Ag êAgCl êHCl(a I)¦HCl(a II) êAgCl êAg Сумма всех электродных процессов дает общее уравнение электрохимической реакции в анионной цепи: t +H+I + t +Cl-I = t +H+II + t +Cl-II Выражение для ЭДС анионной концентрационной цепи второго рода имеет вид: Е = Ео + Процесс, вызывающий появление ЭДС в цепях такого рода, заключается в переносе электролита из концентрированного раствора в разбавленный; концентрационные цепи второго рода называются поэтому также цепями с переносом. Существование между растворами границы, через которую совершается перенос ионов и где локализуется диффузионный потенциал, позволяет определять их также как цепи с жидкостной границей.
1.5) Химические цепи. Источники тока. Элементы вестона. Якоби-Далиэля. Лекланше. Свинцовый аккумулятор. ХИМИЧЕСКИЕ ЦЕПИ. Химические цепи принято разделять на простые и сложные. В простых химических цепях один из электродов обратим по отношению к катионам электролита, а другой - к его анионам. В сложных химических цепях это условие не соблюдается. ПРОСТЫЕ ХИМИЧЕСКИЕ ЦЕПИ. В водородно-кислородном элементе М1 êН2 êН2О êО2 êМ2 источником электрической энергии служит химическая энергия реакции между кислородом и водородом с образованием воды: Н2 + 1/2 О2 = Н2О Другим примером простых химических цепей может служить стандартный элемент Вестона Pt êHg, Cd êCdSO4 êHg2SO4 êHg êPt ЭДС которого отличается очень большим постоянством во времени и малым температурным коэффициентом. В элементе Вестона левый электрод обратим по отношению к ионам кадмия Cd = Cd2+ + 2 e а правый - по отношению к сульфат-ионам Hg2SO4 + 2 e = 2Hg + SO42- Общая реакция, протекающая в элементе: Cd + Hg2SO4 = Cd2+ + SO42- + 2Hg При учете постоянства активностей твердых веществ ЭДС элемента Вестона описывается уравнением: Е = Ео - СЛОЖНЫЕ ХИМИЧЕСКИЕ ЦЕПИ. Примером сложных химических цепей является элемент Даниэля-Якоби: Zn êZnSO4¦CuSO4 êCu в котором протекает реакция Zn + Cu2+ = Zn2+ + Cu Левый электрод - отрицательный полюс элемента - обратим по отношению к ионам цинка, а правый - положительный полюс элемента - по отношению к ионам меди. ЭДС элемента Даниэля-Якоби зависит поэтому от отношения активностей ионов меди и цинка: Е = Ео + СДВОЕННЫЕ ХИМИЧЕСКИЕ ЦЕПИ. В сдвоенных химических цепях две простые химические цепи, отличающиеся лишь активностьюэлектролита, имеют один общий электрод и, т.о., электрически соединены через проводник первого рода в единую цепь. Например, простые цепи с хлорсеребряным и водородным электродами можно превратить в сдвоенную цепь с общим водородным электродом: Ag êAgCl êHCl(a I) êH2 êPt êH2 êHCl(a II) êAgCl êAg В каждой из двух ячеек цепи протекает одна и та же реакция Ag+H++Cl-=AgCl+1/2H2 но в противоположных направлениях, причем если a I > a II, то в первой ячейке реакция идет слева направо, а во второй - справа налево: Ag + H+I + Cl-I = AgCl + 1/2 H2 AgCl + 1/2 H2 = Ag + H+II + Cl-II Суммарный процесс эквивалентен переносу 1 моль ионов водорода и 1 моль ионов хлора из первой ячейки во вторую: H+I + Cl-I = H+II + Cl-II хотя фактический перенос в этой системе из-за отсутствия непосредственной границы раздела между растворами исключен и изменение содержания HCl обусловлено не переносом ионов, а химическими реакциями, протекающими в цепи. Сдвоенные химические цепи называют поэтому часто цепями без переноса или цепями без жидкостной границы. Химические источники тока Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока. Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен. Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы. СВИНЦОВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой элемент: (-) Pb êPbSO4 êH2SO4 (32-34 %) êPbO2 êPb (+) Здесь имеется два электрода второго рода: свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод). При работе аккумулятора протекают следующие электродные реакции: на левом электроде (свинцово-сульфатном) Pb + SO42- на правом электроде (свинцово-диоксидном) PbO2(т)+4H++SO42-+2 e Суммарная реакция в цепи:Pb+PbO2(т)+4H++SO42- Откуда ЭДС цепи равна:Е = Ео + (поскольку Элемент Лекланше В качестве электродов в «сухом элементе» выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют еще угольно — цинковым элементом. Положительным электродом «+» является угольный стержень, отрицательным — цинковый стакан. Угольный стержень окружен смесью диоксида марганца (MnO2) и угля (сажи). В качестве электролита выступает раствор хлорида аммония (NH4Cl) с небольшой добавкой хлорида цинка (ZnCl2) загущенный крахмалом и мукой. Катод: Zn → Zn 2+ + 2e− На угольном стержне электроны расходуются на восстановление H3O+-ионов: Анод: 2MnO2 + 2 H3O++ 2e− → 2MnO(OH) + 2H2O При восстановлении H3O+-ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды: 2MnO2 + 2 H3O+ + 2e− → 2MnO(OH) + 2H2O Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется. В общем: 2NH4Cl + 2H2O ↔ 2NH3 + 2 H3O+ + 2Cl− Образующиеся на катоде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль: Раствор электролита: Zn2+ + 2NH4+ + 2Cl− + 2H2O ↔ [Zn(NH3)2]Cl2 + 2H3O+ Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO(OH) + [Zn(NH3)2]Cl2
2.5) Термодинамика гальванического элемента. Температурный коэффициент ЭДС. Уравнение (правило) Томпсона.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 645; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.161.245 (0.011 с.) |

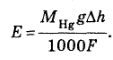
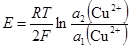
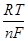 ln
ln 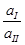
 ln
ln 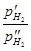
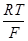 ln
ln  = t +
= t + 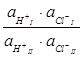 = 2 t + 2,303
= 2 t + 2,303 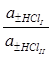
 = Ео -
= Ео - 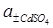
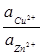
 PbSO4 (т) + 2 е
PbSO4 (т) + 2 е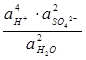 = Ео +
= Ео + 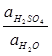
 - общей активности серной кислоты)
- общей активности серной кислоты)


