
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация дисперсных системСодержание книги
Поиск на нашем сайте
ВВЕДЕНИЕ
Коллоидная химия – наука о физико-химических свойствах дисперсных систем и поверхностных явлений. В 1861-64 гг. английский ученый Грем, изучая диффузию растворов, заметил, что некоторые вещества в растворах диффундируют очень медленно. Растворы таких веществ, как крахмал, агар, декстрин по физическому состоянию напоминают клей (kolla греч. клей); поэтому Грем предложил все подобные вещества называть коллоидами, а науку, их изучающую, – коллоидной химией. Природные объекты и искусственные материалы, как правило, представляют собой дисперсные системы. Воздух, насыщенный мельчайшими капельками воды (туман), почва, водоэмульсионные краски, зубная паста, кремы, цемент, сплавы металлов и тысячи других природных и созданных человеком объектов и материалов представляют собой дисперсные системы, в которых поверхность раздела фаз проявляет специфические свойства. Дисперсной системой называется совокупность раздробленных частиц вместе со средой, в которой они находятся. Дисперсность [лат. dispersus рассеянный, рассыпанный ] предполагает наличие поверхности, отделяющей одно вещество от другого, при этом одно вещество раздроблено до небольших частиц в сплошной среде другого. Чем меньше размер частиц, тем больше поверхность, разделяющая вещества, и тем в большей степени свойства дисперсной системы определяются свойствами поверхности раздела фаз. Рассмотрим свойства, практическое применение и различные виды дисперсных систем.
ТЕМА 1 Классификация дисперсных систем по Агрегатному состоянию Классификация дисперсных систем по агрегатному состоянию построена на выделении агрегатного состояния дисперсионной среды (в чем) и дисперсной фазы (что) (табл. 2). Дисперсионная среда может быть твердой (Т), жидкой (Ж) или газообразной (Г). В этих средах распределены частицы дисперсной фазы, которые также могут представлять собой твердые частицы (Т), жидкие капли (Ж) или пузырьки газа (Г). Природные и искусственные дисперсные системы относятся к одному из классов, представленных в табл. 2. Т а б л и ц а 2 Краткий итог темы Среди веществ, изучаемых химией, особое место занимают дисперсные системы с ярко выраженными специфическими свойствами, присущими поверхности раздела фаз.
По мере дробления вещества дисперсной фазы до размеров, приближающихся к размеру атомов, молекул, ионов, дисперсная система переходит в состояние коллоидного раствора или золя (размер частиц 10-9 ¸ 10-7 м). Частицы коллоидного раствора настолько малы, что их невозможно увидеть в оптический микроскоп, но они представляют собой агрегаты, состоящие из множества атомов, молекул или ионов. Эти агрегаты, подобно молекулам участвуют в тепловом движении, распределяясь по всему объему жидкой или газообразной дисперсионной среды, поэтому не удивительно, что высокодисперсные системы называют коллоидными растворами. Классификация дисперсных систем охватывает весь спектр свойств, проявляемых поверхностью раздела фаз при взаимодействии дисперсной фазы и дисперсионной среды: 1) по размеру частиц дисперсной фазы (высокодисперсные, средне- и грубодисперсные системы); 2) по агрегатному состоянию дисперсной фазы и дисперсионной среды (частицы твердой, жидкой или газообразной дисперсной фазы в твердой, жидкой или газообразной дисперсионной среде); 3) по межфазному взаимодействию дисперсной фазы и дисперсионной среды (лиофильные и лиофобные дисперсные системы); 4) по кинетическим свойствам (характер движения частиц дисперсной фазы в свободно- и связнодисперсных системах).
Термины для запоминания Гетерогенная (неоднородная) система состоит из двух или большего числа фаз. Гомогенной (однородной) системой называется вещество, структурными частями которого являются атомы, молекулы или ионы. Дисперсионная среда – газ, жидкость или твердое тело, в котором распределены раздробленные частицы. Дисперсная фаза – раздробленные частицы дисперсной системы. Дисперсной системой называется совокупность раздробленных частиц и среды, в которой они находятся. Дисперсность или раздробленность - степень измельченности вещества в дисперсной системе. Золь – высокодисперсная система, коллоидный раствор. Коллоидная химия – наука о поверхностных явлениях и физико-химических свойствах дисперсных систем. Лиофильные золи – высокодисперсные термодинамически устойчивые системы, самопроизвольное образование которых происходит в результате взаимодействия дисперсной фазы и дисперсионной среды.
Лиофобные золи – высокодисперсные термодинамически неустойчивые системы, характеризующиеся отсутствием или слабым взаимодействием между дисперсной фазой и дисперсионной средой. Набухание – процесс поглощения растворителя полимером, сопровождающийся увеличением массы и объема последнего. Свободнодисперсные системы – системы с подвижной дисперсной фазой в жидкой или газообразной дисперсионной среде. Связнодисперсные системы – системы, частицы дисперсной фазы которых образуют каркас, сообщающий этим системам прочность. Удельная поверхность s уд. – площадь поверхности раздела фаз, приходящаяся на единицу объема [м2/м3] или единицу массы дисперсной фазы [м2/кг]. Фаза – часть системы, характеризующаяся одинаковыми физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела.
Вопросы для проверки знаний 1. Что изучает коллоидная химия? 2. Какие примеры указывают на особую роль поверхности дисперсной системы? 3. Какая из фаз обладает более высокой степенью раздробленности - дисперсная фаза или дисперсионная среда? 4. Можно ли считать масляную пленку на поверхности воды частицей дисперсной фазы? 5. Относятся ли высокодисперсные системы к коллоидным растворам или золям? 6. В чем принципиальное различие между лиофильными и лиофобными золями? 7. Какой основной признак отличает свободно- и связнодисперсные системы?
Упражнения 1. Приведите аргументы, подтверждающие или опровергающие утверждение, что коллоидная химия изучает наиболее распространенное в природе состояние тел. 2. Рассчитайте, во сколько раз увеличится поверхность газового пузырька в воде, если при своем движении вверх он разбился на 1000 мелких одинаковых по размеру пузырьков. Различием гидравлического давления можно пренебречь. 3. В креме после бритья капли эмульсии имеют размер d = 5×10-6 м. Вычислите удельную поверхность дисперсной фазы, если известно, что плотность капель эмульсии r = 1.1×103 кг/м3 4. На электростанции каменный уголь, измельченный до порошка с размером частиц d = 1×10-6 м, сжигают в пламени форсунки. В таких условиях повышается эффективность полного сгорания частичек угля. Вычислите, во сколько раз увеличивается удельная поверхность при дроблении 1 кг каменного угля, имеющего плотность r = 1.3×103 кг/м3.
ТЕМА 2 Поверхностное натяжение Известно, что шар имеет наименьшую площадь поверхности, по сравнению с любой фигурой, имеющей такой же, как шар, объем. При плавлении небольшого кристалла льда происходит самопроизвольное образование капли воды, поверхность которой представляет сферу (рис. 3).
Рис. 3. Изменение геометрических параметров тела при самопроизвольном превращении кристалла льда (куб) в каплю воды (шар)
Самопроизвольное сокращение площади поверхности объясняется проявлением энергии поверхностного натяжения (рис. 4).
Рис. 4. Модель межмолекулярного взаимодействия на поверхности раздела фаз газ-жидкость и в объеме жидкости. Проявление поверхностного натяжения s
Поверхностный слой молекул жидкости испытывает действе сил притяжения со стороны молекул жидкой и газовой фаз. Притяжение со стороны газовой фазы пренебрежимо мало в силу небольшой концентрации вещества газовой фазы, поэтому равнодействующая сил притяжения на поверхности направлена внутрь жидкой фазы (рис. 4). Внутри жидкости силы, действующие на молекулы со стороны окружения, взаимно компенсированы. В этом можно убедиться на примере диполя, выделенного темным цветом (рис. 4).
Нереализованное притяжение со стороны газовой фазы на поверхности жидкости количественно оценивается энергией поверхностного натяжения s. Критерием самопроизвольного изменения поверхности термодинамической системы является уменьшение функции Гиббса. При постоянном давлении и температуре (р,Т = const): dG = s×ds < 0, (2.1) где s – удельное поверхностное натяжение, которое в дальнейшем будем называть просто поверхностным натяжением; ds – изменение площади поверхности дисперсной фазы. Из уравнения (2.1) следует
где А – работа, совершаемая системой: dA = sds. (2.2) Интегрируем уравнение (2.2):
A = s △ s. (2.3) При расчете работы A, затраченной на изменение единицы площади поверхности (△ s = 1), получаем: A = s Дж/м2 Поверхностное натяжение s определяется количеством энергии в форме работы, приходящейся на изменение единицы площади поверхности дисперсной фазы. Небольшие капли любого жидкого вещества, в газовой фазе, всегда принимают форму шара, поверхность которого имеет площадь, наименьшую из возможных. Большие массы жидкости всегда деформируются. Энергия поверхностного натяжения неспособна удержать сферическую форму вещества и противостоять гравитации. Жидкость заполняет сосуд и принимает его форму или растекается по поверхности. Только благодаря силам гравитации большая масса воды Мирового океана покрывает относительно тонким слоем поверхность земного шара.
Пример. Оценим сокращение площади поверхности, которое происходит при плавлении куска льда в форме куба в каплю жидкости со сферической поверхностью. Пусть, ребро куба l =1 см. Объем и поверхность куба соответственно равны V куб = 1 см3 и S куб = 6 см2. Капля жидкости того же объема имеет меньшую площадь поверхности: Vшар = Vкуб = 4 p r 3/3 = 1 см3, r = sшар = 4 p r 2 или sшар = 4×3.14×(0.62)2 = 4.83 см2. Произошло самопроизвольное сокращение поверхности тела с 6 см2 (лед в форме куба) до 4.83 см2 (сферическая поверхность капли воды) за счет энергии поверхностного натяжения.
Смачивание Смачивание есть взаимодействие жидкости с твердым телом в присутствии газа или другой жидкости, которая не смешивается с первой. На границе раздела фаз молекулы, расположенные на соприкасающихся поверхностях, притягиваются за счет сил Ван-дер-Ваальса (ориентационное, индукционное и дисперсионное взаимодействие) или посредством водородных связей.
Мерой смачивания является угол смачивания или краевой угол. Краевой угол q определяется наклоном поверхности капли жидкости к смоченной ею поверхности твердого тела в точке соприкосновения фаз со стороны жидкости (рис. 5). Изменение краевого угла в пределах 0 < q < 1800, охватывает все случаи смачивания. Значение q = 00 соответствует полному смачиванию. Например, капля воды на обезжиренной стеклянной поверхности растекается и покроет поверхность стекла тонкой пленкой (q = 0). Растекание жидкости происходит потому, что молекулы воды (диполи) притягиваются поверхностью, молекулярная структура которой обеспечивает ориентационное, индукционное или дисперсионное взаимодействие с аморфной поверхностью стекла. Изменение угла q в пределах 00 < q < 900 указывает на ограниченное смачивание. Несмачиванию соответствует угол 900 < q < 1800. Различное смачивание водой поверхности стекла,графита и парафина представлено на рис. 5.
Рис. 5. Положение капли воды на твердых поверхностях при различных условиях смачивания: а) гидрофильное обезжиренное стекло; б)графит; в) парафин, проявляет гидрофобные свойства
Поверхность проявляет гидрофильные (др.-греч. ugroV влажный; jilew люблю) свойства, если она хорошо смачивается водой (обезжиренное стекло). Гидрофобные (др.-греч. ugroV влажный; joboV страх, ужас) свойства, т.е. плохое смачивание водой, наблюдается у парафина. Когда речь идет о жидкостях, отличающихся от воды, то поверхности по условиям смачивания подразделяются соответственно на лиофильные и лиофобные. Уменьшение функции Гиббса (приходящееся на единицу поверхности) sт-г - sт-ж> 0. Равновесное (устойчивое) состояние (рис. 6) будет достигнуто, когда равнодействующая поверхностного натяжения трех фаз равна нулю (уравнение Юнга):
sт-г - sт-ж - sж-г cos q = 0 или cos q = (sт-г - sт-ж)/sж-г.
Рис. 6. Распределение энергии поверхностного натяжения: а) на гидрофильной поверхности (q < 900); б) на гидрофобной поверхности (q > 900)
Из уравнения Юнга следует, что при sт-г - sт-ж> 0 значение cos q > 0, и тогда q изменяется в пределах от 00 до 900. Величина краевого угла свидетельствует об эффективности смачивания, эффективности контактного взаимодействия жидкости с поверхностью твердого тела. Если sт-г - sт-ж < 0, то значение cos q < 0, и q изменяется в пределах от 900 до 1800, что означает плохое смачивание или отсутствие смачивания поверхности жидкостью. В последнем случае ярко выражено более сильное взаимодействие между молекулами внутри жидкости по сравнению с взаимодействием молекул на границе двух фаз.
Изменение степени смачивания происходит при использовании поверхностно-активных веществ (ПАВ) и означает изменение поверхностной энергии на границе раздела фаз.
Адгезия Адгезия – это прилипание находящихся в контакте поверхностей разной природы. Явление адгезии наблюдается между поверхностями в системах: твердое тело – твердое тело, твердое тело – жидкость, жидкость – жидкость. Адгезия между телами реализуется преимущественно за счет сил Ван-дер-Ваальса или водородных связей. Два тела прилипают при контакте поверхностями в результате уменьшения энергии поверхностного натяжения, присущего самопроизвольным, термодинамически разрешенным процессам, о которых говорилось при обсуждении явления смачивания. Тело, которое прилипает, называют адгезивом. Тело, к которому прилипает адгезив, называется субстратом. Чаще всего субстратами являются разнообразные твердые тела (металлы, пластмасса, керамика, стекло, поверхность древесины и т.д.). Слипание твердых частиц называют аутогезией, если слипаются частицы одного и того же вещества, например частицы порошка. В результате аутогезии изменяется их сыпучесть. Количественно энергию (работу) адгезии удается рассчитать для систем, в которых, по крайней мере, одно из тел является жидкостью, т.к. для жидкостей существуют удобные экспериментальные методы определения поверхностного натяжения на границе раздела фаз жидкость – газ (sж-г) и жидкость – жидкость(sж-ж). Прилипание жидкости к твердому телу сопровождается уменьшением поверхностной энергии (выделением энергии), следовательно, для отрыва твердого тела от жидкости требуется затратить энергию - работу адгезии, А адг. Уравнение для определения работы адгезии А адг можно вывести, исходя из модели взаимодействия, представленной на рис. 7.
Рис. 7. Модель изменения поверхностного натяжения межфазных поверхностей, позволяющая вывести уравнение работы адгезии А адг
В системе жидкость – твердое тело (рис. 7, а) отрыв твердого тела от жидкого связан с затратой энергии на образование двух новых поверхностей (рис. 7, б): жидкость – газ (sж-г) и твердое тело – газ (sт-г). При этом происходит потеря энергии (sт-ж) в результате исчезновения поверхности твердое тело – жидкость. Баланс энергетических затрат в форме работы адгезии представлен уравнением (2.4): А адг = (sт-г + sж-г) – sт-ж.. (2.4) Входящая в уравнение работы адгезии величина sж-г экспериментально легко определяется в отличие от величин sт-г и sт-ж. Но значения sт-г и sт-ж можно заменить на sж-г, используя уравнение Юнга. cos q = (sт-г - sт-ж)/sж-г. (2.5) Разделение фаз требует совершения работы адгезии, которую можно определить, решая совместно уравнения (2.4) и (2.5): А адг = sж-г (1 – cos q). (2.6)
Адсорбция Адсорбцией называется концентрирование вещества на поверхности раздела фаз. Физическая адсорбция – обратимый процесс концентрирования вещества на поверхности, который осуществляется под действием сил Ван дер Вальса (рис. 9, а) или в результате образования водородных связей (рис. 9, б).


Рис. 9. Модели взаимодействия адсорбтива с адсорбционными центрами. Физическое взаимодействие: а) дисперсионное; б) образование водородных связей. Химическое взаимодействие (в) или хемосорбция
Энергия такого взаимодействия лежит в пределах 10 ¸ 100 кДж/моль и не приводит к разрыву и образованию новых химических связей. Химическая адсорбция – необратимая химическая реакция адсорбтива с адсорбентом на поверхности раздела фаз (рис. 9, в). Фактически адсорбтив и адсорбент выступают в роли реагентов экзотермической химической реакции, сопровождающейся выделением энергии в количестве 200 ¸ 400 кДж/моль. В дальнейшем мы будем рассматривать главным образом физическую адсорбцию. Поверхность, на которой происходит концентрирование вещества, называется адсорбентом. Адсорбирующееся вещество называется адсорбтивом, если оно находится в объеме и адсорбатом, если закрепилось на поверхности адсорбента.
Краткий итог темы 1. Любое конденсированное тело содержит в поверхностном слое микрочастицы, равнодействующая сил межмолекулярного (ионного) взаимодействия которых направлена внутрь тела, что создает поверхностное натяжение. 2. Следствием межмолекулярного взаимодействия на поверхности раздела фаз являются такие процессы, как смачивание, адгезия и адсорбция. 3. Для проявления смачиваниянеобходимо, чтобы жидкость вступала во взаимодействие с твердым телом в присутствии газа или другой жидкости, которая не смешивается с первой. 4. Явление адгезии (прилипания) наблюдается в случае, когда между телами реализуется преимущественно ван-дер-ваальсово взаимодействие или водородные связи. Два тела прилипают при контакте поверхностями в результате уменьшения энергии поверхностного натяжения. 5. Физическая адсорбция – процесс концентрирования вещества на поверхности, который осуществляется под действием сил Ван дер Вальса или в результате образования водородных связей. 6. Химическая адсорбция отличается от физической адсорбции необратимостью вследствие того, что адсорбат участвует в химической реакции с активными центрами поверхностного слоя адсорбента. 7. Ионная адсорбция происходит в результате обратимого ионного обмена.
Термины для запоминания Адгезив – тело, которое прилипает. Адгезия – это прилипание находящихся в контакте поверхностей разной природы. Адсорбат – адсорбированное вещество. Адсорбентом называется тело, на поверхности которого происходит концентрирование вещества из объема. Адсорбтивом называется вещество, которое находится в объеме жидкой или газовой фазы, способное адсорбироваться на поверхности. Адсорбция – концентрирование вещества на поверхности раздела фаз. Активные (активированные) угли приготавливают специальной обработкой каменного и древесного угля. Получают пористые крупнозернистые порошки с удельной поверхностью 200 – 450 м2/г. Волокнистые углеродистые адсорбенты имеют удельную поверхность 500 – 2000 м2/г. Используются для изготовления средств индивидуальной защиты органов дыхания. Ионообменная адсорбция – обратимый процесс стехиометрического обмена ионами между ионообменной смолой и раствором электролита. Поверхностно-активное вещество (ПАВ) – это химическое соединение, структура которого включает неполярную углеводородную цепь (например, такую группу, как СН3(СН2)nСН2-), соединенную с полярной группой, например такой, как -СООNa. Поверхностное натяжение s определяется количеством энергии в форме работы, приходящегося на изменение единицы площади поверхности дисперсной фазы. Силикагель (аморфная форма оксида кремния SiO2) в виде порошка с удельной поверхность 5 – 800 м2/г. применяют как адсорбент для осушки газов и органических жидкостей от влаги. Смачивание - прилипание (адгезия) жидкости к твердой поверхности. Субстрат – тело, к которому прилипает адгезив. Физическая адсорбция – обратимый процесс концентрирования вещества на поверхности, который осуществляется под действием сил Ван дер Ваальса или в результате образования водородных связей. Химическая адсорбция – необратимая химическая реакция адсорбтива с адсорбентом на поверхности раздела фаз. Цеолиты – специально прогретые белые, иногда бесцветные порошки алюмосиликатов, являются молекулярными ситами – микропористыми материалами, способными избирательно поглощать вещества, размеры молекул которых меньше размеров микропор.
Вопросы для проверки знаний 1. В чем причина нескомпенсированности сил межмолекулярного взаимодействия на границе раздела фаз? 2. Какой физический смысл несет понятие «поверхностное натяжение»? 3. Какие межмолекулярные взаимодействия определяют явления смачивания и адгезии? 4. Справедливо ли утверждение, что «уменьшение поверхностного натяжения, процессы смачивания и прилипания (адгезии) являются самопроизвольными процессами»? 5. Почему поверхностно-активные вещества уменьшают поверхностное натяжение? 6. В чем различие между физической, химической и ионообменной адсорбцией? 7. В чем различие между адсорбентом, адсорбтивом и адсорбатом?
Упражнение 1. Докажите, к физической или химической адсорбции относится адсорбционный процесс, сопровождающийся выделением 300 кДж/моль энергии.
ТЕМА 3 Электрокинетические явления Электрокинетические явления – это движение дисперсной фазы и дисперсионной среды под воздействием внешнего электрического поля или возникновения разности потенциалов при движении дисперсной фазы и дисперсионной среды. К такому виду явлений относится электроосмос - этовызванное внешним электрическим полем движение дисперсионной среды относительно неподвижной дисперсной фазы и электрофорез - движение частиц дисперсной фазы относительно дисперсионной среды, такжевызванное внешним электрическим полем. К электрокинетическим явлениям относятся также явления, противоположные электроосмосу и электрофорезу. При протекании жидкости через капиллярно-пористую перегородку возникает разность потенциалов на электродах, расположенных на концах пористой перегородки (потенциал протекания). Между электродами, расположенными на разной высоте, также возникает разность потенциалов, если в сосуде происходит оседание частиц дисперсной фазы (потенциал седиментации).
Электроосмос Напомним о явлении осмоса (др.-греч wsmoV толчок, давление). В общем случае осмос – односторонний перенос растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией растворенного вещества через полупроницаемую перегородку, разделяющую растворы. Известны полупроницаемые перегородки (мембраны), пропускающие только растворитель и другие – пропускающие только растворенное вещество. Различные биологические мембраны проницаемы не только для частиц растворителя, но избирательно пропускают некоторые ионы и молекулы растворенных веществ. В данном разделе рассматриваются осмотические явления с участием мембран, пропускающих растворитель. На рис. 23 представлен термодинамически разрешенный (самопроизвольный) процесс выравнивания концентраций в результате перехода растворителя из менее концентрированного в более концентрированный раствор через мембрану. В результате осмоса объем раствора в коленах U-образного сосуда изменяется. Создается препятствующее осмосу гидростатическое давление (осмотическое давление p) столба жидкости h, в итоге наступает осмотическое равновесие.
исходное состояние конечное (равновесное) состояние системы
Рис. 23. Схема прибора, демонстрирующего явление осмоса.
Если в одном колене находится раствор соли, а в другом – чистая вода, то высота столба жидкости и, соответственно, осмотическое давление тем больше, чем больше концентрация соли в воде: p = сRT. Электроосмос не является самопроизвольным процессом. Требуется затратить некоторое количество электрической энергии на перемещение растворителя из одного колена в другое через мембрану, функцию которой может выполнять, например, кварцевый песок (рис. 24).
Рис. 24. Явление электроосмоса в U-образной трубке, заполненной кварцевым песком и водой: а) уровни воды в обоих коленах одинаковые, система находится в состоянии равновесия; б) при наложении электрического поля наблюдается перемещение жидкости, происходящее до тех пор, пока не будет достигнуто давление, препятствующее дальнейшему изменению уровней
Под воздействием постоянного электрического поля наблюдается изменение уровней жидкости в коленах U-образной трубки, содержащей кварцевый песок. В результате реакции: SiO2 + 2H2O ® H2SiO3 + H2O ® H3O+ + HSiO3- частицы дисперсной фазы (кварцевого песка) представляют собой мицеллы. Мицелла
ядро двойной электрический слой диффузный слой
Окруженные двойным электрическим слоем частицы кварца создают условия, когда при действии внешнего электрического поля гидратированные ионы диффузной части (Н3О+) мицеллы перемещаются к отрицательному электроду, повышая уровень жидкости в левой части U-образного колена (рис. 24). На рис. 25 показана модель движения гидратированных ионов диффузного слоя внутри капилляра из кварцевого песка в результате действия электроосмоса. Положительно заряженные противоионы Н3О+ движутся в направлении отрицательно заряженного электрода источника тока.
Рис. 25. Модель электроосмоса – модель движения гидратированных ионов диффузного слоя внутри капилляра из кварцевого песка
Электроосмос используется при обезвоживании капиллярно-пористых тел, сыпучих материалов, сахарных сиропов, при очистке воды и осушке стен зданий. Известно, что при нарушении гидроизоляции стен подвальных помещений они сыреют от почвенной влаги, проникающей в стены по капиллярам. В этом случае для осушки стен используют электроосмос. В верхнюю часть стены подвального помещения вблизи потолка устанавливают один электрод, а другой помещают в грунт через отверстие в полу. Знаки электродов устанавливают так, чтобы влага в составе гидратированных ионов диффузного слоя уходила по капиллярам из стены в почву. Стены старых зданий необходимо не только сушить. Для поддержания их в сухом состоянии приходится постоянно поддерживать разность потенциалов, препятствующую увлажнению стен капиллярной водой в течение всего времени дальнейшей эксплуатации здания.
Электрофорез Явление электрофореза, вызванное внешним электрическим полем, наблюдается, когда частицы дисперсной фазы могут свободно перемещаться в дисперсионной среде. Для изучения электрофореза используют высокодисперсные системы – золи. Явление электрофореза - подобно электролизу, с тем отличием, что в дисперсионной среде в движении участвуют не только ионы, но и заряженные частицы дисперсной фазы. Прибор, с помощью которого можно наблюдать электрофорез, представлен на рис. 26. С помощью кранов колена U-образной трубки соединены с золем той же электропроводности, что и электролит. Золь подают снизу через воронку при открытых кранах. После заполнения золем колен U-образной трубки кран у воронки закрывают и замыкают электрическую цепь. Наблюдают перемещение золя к тому электроду, который имеет знак, противоположный заряду частиц дисперсной фазы. Электрофорез широко применяется в исследовании биологических систем и в медицине (физиотерапия). С помощью электрофореза проводят разделение природных белков различной структуры, определяют степень чистоты антибиотиков и витаминов. Примером технического применения электрофореза может служить окраска кузовов автомобилей в электрическом поле высокого напряжения.
Рис. 26. Схема прибора для электрофореза: а) исходное состояние системы; при открытых кранах снизу через воронку заливают золь в колена U-образной трубки, содержащие раствор электролита; б) при закрытом кране у воронки включают источник постоянного тока и наблюдают явление электрофореза по изменению уровней золя в коленах.
Краткий итог темы 1. На поверхности твердых частиц дисперсной фазы в дисперсионной среде всегда образуется двойной электрический слой за счет избирательной адсорбции ионов из раствора или действия сил Ван-дер-Ваальса. 2. Двойной электрический слой состоит из потенциалоопределяющих ионов, находящихся на поверхности твердой частицы и эквивалентного количества противоионов, располагающихся в дисперсионной среде вблизи поверхности твердой частицы. 3. Заряженные частицы дисперсной фазы имеют одинаковый заряд и движутся независимо от диффузной (подвижной) части двойного электрического слоя. 4. Частица, с окружающим её диффузным слоем, представляет собой электронейтральную систему – мицеллу. 5. Для дисперсных систем характерны электрокинетические явления: электроосмос, электрофорез, потенциал течения и потенциал седиментации, проявление которых зависит от величины диффузного потенциала (дзета-потенциала).
Термины для запоминания Граница скольжения лежит между адсорбционным и диффузным слоем или слегка удаляется от адсорбционного в диффузный слой. Двойной электрический слой, окружающий ядро мицеллы, включает ионы адсорбционного и диффузного слоя. Дзета-потенциал (z) – потенциал границы скольжения. Определяет скорость перемещения дисперсной фазы относительного дисперсионной среды. Мицелла – частица дисперсной системы, состоящая из ядра и двойного электрического слоя Потенциал протекания – скачок разности потенциалов, возникающий на электродах, расположенных на концах капиллярно-пористой перегородки, при протекании через нее жидкости. Потенциал седиментации – скачок разности потенциалов, возникающий на электродах, расположенных на разной высоте в сосуде, в котором происходит оседание частиц дисперсной фазы. Правило Панета-Фаянса: на поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достроить её кристаллическую решетку. Электрокинетические явления – процессы движения дисперсной фазы и дисперсионной среды под воздействием внешнего электрического поля или возникновение электрической разности потенциалов при движении дисперсной фазы и дисперсионной среды. Электроосмос – движение дисперсионной среды относительно неподвижной дисперсной фазы,вызванное внешним электрическим полем. Электрофорез – движение частиц дисперсной фазы относительно дисперсионной среды, вызванное внешним электрическим полем.
Вопросы для проверки знаний 1. Почему на поверхности твердых частиц дисперсной фазы возникает двойной электрический слой? 2. С каким свойством мицелл связаны электрокинетические явления? 3. В чем сходство и различие между электроосмосом и электрофорезом? 4. В чем сходство и различие между явлениями, вызывающими появление потенциалов течения и седиментации? 5. Какие процессы являются самопроизвольными (термодинамически разрешенными) среди перечисленных: электроосмос, электрофорез, потенциал течения, потенциал седиментации? 6. Препятствует ли двойной электрический слой слипанию частиц дисперсной фазы? 7. Какая причина может вызвать изменение знака заряд
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 338; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.244.228 (0.018 с.) |



 или
или ,
,
 = 0.62 см,
= 0.62 см,










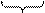

 [SiO2] mn HSiO3 - |(n - у) H3O+ | у H3O+.
[SiO2] mn HSiO3 - |(n - у) H3O+ | у H3O+.




