
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрические свойства дисперсных системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Частицы жидкой или твердой дисперсной фазы проявляют электрические свойства. Согласно современным представлениям взаимодействие частиц дисперсной фазы и дисперсионной среды приводит к образованию двойного электрического слоя на межфазной поверхности. Процесс происходит самопроизвольно в результате стремления системы уменьшить поверхностное натяжение на границе раздела фаз и перейти в устойчивое состояние. Критерием самопроизвольного протекания процесса служит функция Гиббса D Gсист. < 0.
3.1. Механизм образования двойного электрического слоя на границе раздела фаз Образование двойного электрического слоя возможно в результате ориентационного, индукционного или дисперсионного взаимодействия молекул, расположенных на поверхностях соприкасающихся фаз. В этом случае поверхность одной из соприкасающихся фаз заряжается положительно, другой – отрицательно (рис. 18).
Рис. 18. Модель образования двойного электрического слоя на границе раздела фаз в результате индукционного взаимодействия: а) поверхности двух фаз до контакта; б) образование двойного электрического слоя
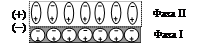
Положительный заряд несет поверхность, вещество которой имеет большую диэлектрическую проницаемость. Так происходит с водой, поверхность которой заряжается положительно при контакте с поверхностью менее полярных веществ (рис. 18). Другой путь возникновения двойного электрического слоя реализуется в результате избирательной адсорбции катионов или анионов на границе раздела фаз твердое тело – раствор электролита. Так происходит образование устойчивого золя (высокодисперсной коллоидной системы) йодистого серебра в результате обменной реакции: AgNO3(р-р) + KI(р-р) ® AgI(т)¯ + KNO3(р-р), Ag+(р-р)+NO3-(р-р) + K+(р-р) + I-(р-р) ® AgI(т)¯+ K+(р-р) + NO3-(р-р), Ag+(р-р) + I-(р-р) ® AgI(т)¯. На поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достроить её кристаллическую решетку (правило Панета-Фаянса). Если одна из солей, участвующая в обменной реакции, взята в избытке, например, избыток AgNO3 по отношению к KI – образуются микрокристаллы AgI (ядра) в окружении родственных кристаллической решетке положительно заряженных ионов серебра. Ионы серебра «достраивают» кристаллическую решетку уже в отсутствие ионов йода. Формируется мицелла (рис. 19), состоящая из ядра и двойного электрического слоя:
Мицелла
ядро двойной электрический слой где m - количество ионных пар в структуре ядра, n - количество потенциалопределяющих ионов, у - количество противоионов в диффузной части двойного электрического слоя.
   
Рис. 19. Модель мицеллы [AgI] mn Ag+|(n - у)NO3 - | у NO3 -.
Рис. 20. Модель распределения зарядов в двойном электрическом слое мицеллы йодистого серебра в водном растворе, содержащем избыток AgNO3; х – расстояние от поверхности частицы в объем жидкой фазы
Двойной электрический слой, окружающий ядро, включает ионы адсорбционного и диффузного слоя (рис. 20). По мере удаления от поверхности твердого тела на расстояние (х) в объем электролита наблюдается падение разности потенциалов между твердой и жидкой фазами. Полное падение потенциала в двойном электрическом слое называется термодинамическим потенциалом j0. Он включает скачки потенциалов адсорбционной (плотной) и диффузной частей двойного электрического слоя: j0 = jадс + jдиф. Полная компенсация заряда твердой поверхности суммарным зарядом противоионов происходит на расстоянии х, где заканчивается диффузионный слой. Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы и имеет толщину гидратированного иона (гидратированные ионы адсорбционного слоя обведены пунктирными кружками). Ядро с адсорбционным слоем прочно связано электростатическими и адсорбционными силами и образует единое целое – заряженную микрочастицу коллоидного раствора, которая свободно перемещается в дисперсионной среде независимо от диффузного слоя. При движении частицы золя разрывается двойной электрический слой на так называемой границе скольжения. Граница скольжения лежит между адсорбционным и диффузным слоем или несколько удаляется от адсорбционного в диффузный слой. В последнем случае частица «захватывает» при своем движении некоторое количество противоионов диффузного слоя. Дзета-потенциал (z) – потенциал границы скольжения. Он определяет скорость перемещения дисперсной фазы относительного дисперсионной среды (рис. 20).
При избытке в растворе ионов йода (по отношению к ионам серебра) строение мицеллы изменяется:
Мицелла
[AgI] mn I - |(n - у)K + | у K +.
ядро двойной электрический слой
Рис. 21. Модель распределения зарядов в двойном электрическом слое мицеллы йодистого серебра в водном растворе, содержащем избыток КI; х – расстояние от поверхности в объем жидкой фазы
По цвету золь йодистого серебра напоминает молоко. Частицы золя имеют размеры, соответствующие высокодисперсной системе (10-9 ¸ 10-7м). Они не оседают из-за небольшой массы и не слипаются в силу того, что имеют одинаковый знак заряда частиц золя. Обратим еще раз внимание на правило Панета-Фаянса: на поверхности частиц золя адсорбируются родственные кристаллу ионы серебра или йода, и лишь затем располагаются противоионы. Знак и величина заряда частицы зависят в существенной степени от специфической адсорбции потенциалоопределяющих ионов. Может оказаться, что адсорбционные силы и концентрация противоионов настолько высока, что происходит перезарядка частиц золя. В этом случае дзета-потенциал изменяет свой знак (рис. 22).
Рис. 22. Изменение z-потенциала поверхности при перезарядке частиц золя
Так происходит, если к золю йодистого серебра Мицелла
[AgI] mn I - |(n - у)K + | у K +.
ядро двойной электрический слой добавить, например, нитрат железа Fe(NO3)3. Ионы Fe3+ обладают высокой адсорбционной способностью. Они будут входить в адсорбционный (плотный) слой вместе с ионами К+ в таком количестве, что изменят знак заряда частицы золя. При этом ионы Fe3+ не способны достраивать кристаллическую решетку частиц золя в силу действия известного правила Панета-Фаянса, т.к. не имеют никакого сходства по размеру (неизоморфны) с ионами серебра Ag+, входящими в ионную кристаллическую решетку частиц золя: Мицелла
ядро двойной электрический слой Это приводит к перезарядке частиц золя.
Электрокинетические явления Электрокинетические явления – это движение дисперсной фазы и дисперсионной среды под воздействием внешнего электрического поля или возникновения разности потенциалов при движении дисперсной фазы и дисперсионной среды. К такому виду явлений относится электроосмос - этовызванное внешним электрическим полем движение дисперсионной среды относительно неподвижной дисперсной фазы и электрофорез - движение частиц дисперсной фазы относительно дисперсионной среды, такжевызванное внешним электрическим полем. К электрокинетическим явлениям относятся также явления, противоположные электроосмосу и электрофорезу. При протекании жидкости через капиллярно-пористую перегородку возникает разность потенциалов на электродах, расположенных на концах пористой перегородки (потенциал протекания). Между электродами, расположенными на разной высоте, также возникает разность потенциалов, если в сосуде происходит оседание частиц дисперсной фазы (потенциал седиментации).
Электроосмос Напомним о явлении осмоса (др.-греч wsmoV толчок, давление). В общем случае осмос – односторонний перенос растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией растворенного вещества через полупроницаемую перегородку, разделяющую растворы. Известны полупроницаемые перегородки (мембраны), пропускающие только растворитель и другие – пропускающие только растворенное вещество. Различные биологические мембраны проницаемы не только для частиц растворителя, но избирательно пропускают некоторые ионы и молекулы растворенных веществ. В данном разделе рассматриваются осмотические явления с участием мембран, пропускающих растворитель. На рис. 23 представлен термодинамически разрешенный (самопроизвольный) процесс выравнивания концентраций в результате перехода растворителя из менее концентрированного в более концентрированный раствор через мембрану. В результате осмоса объем раствора в коленах U-образного сосуда изменяется. Создается препятствующее осмосу гидростатическое давление (осмотическое давление p) столба жидкости h, в итоге наступает осмотическое равновесие.
исходное состояние конечное (равновесное) состояние системы
Рис. 23. Схема прибора, демонстрирующего явление осмоса.
Если в одном колене находится раствор соли, а в другом – чистая вода, то высота столба жидкости и, соответственно, осмотическое давление тем больше, чем больше концентрация соли в воде: p = сRT. Электроосмос не является самопроизвольным процессом. Требуется затратить некоторое количество электрической энергии на перемещение растворителя из одного колена в другое через мембрану, функцию которой может выполнять, например, кварцевый песок (рис. 24).
Рис. 24. Явление электроосмоса в U-образной трубке, заполненной кварцевым песком и водой: а) уровни воды в обоих коленах одинаковые, система находится в состоянии равновесия; б) при наложении электрического поля наблюдается перемещение жидкости, происходящее до тех пор, пока не будет достигнуто давление, препятствующее дальнейшему изменению уровней
Под воздействием постоянного электрического поля наблюдается изменение уровней жидкости в коленах U-образной трубки, содержащей кварцевый песок. В результате реакции: SiO2 + 2H2O ® H2SiO3 + H2O ® H3O+ + HSiO3- частицы дисперсной фазы (кварцевого песка) представляют собой мицеллы. Мицелла
ядро двойной электрический слой диффузный слой
Окруженные двойным электрическим слоем частицы кварца создают условия, когда при действии внешнего электрического поля гидратированные ионы диффузной части (Н3О+) мицеллы перемещаются к отрицательному электроду, повышая уровень жидкости в левой части U-образного колена (рис. 24). На рис. 25 показана модель движения гидратированных ионов диффузного слоя внутри капилляра из кварцевого песка в результате действия электроосмоса. Положительно заряженные противоионы Н3О+ движутся в направлении отрицательно заряженного электрода источника тока.
Рис. 25. Модель электроосмоса – модель движения гидратированных ионов диффузного слоя внутри капилляра из кварцевого песка
Электроосмос используется при обезвоживании капиллярно-пористых тел, сыпучих материалов, сахарных сиропов, при очистке воды и осушке стен зданий. Известно, что при нарушении гидроизоляции стен подвальных помещений они сыреют от почвенной влаги, проникающей в стены по капиллярам. В этом случае для осушки стен используют электроосмос. В верхнюю часть стены подвального помещения вблизи потолка устанавливают один электрод, а другой помещают в грунт через отверстие в полу. Знаки электродов устанавливают так, чтобы влага в составе гидратированных ионов диффузного слоя уходила по капиллярам из стены в почву. Стены старых зданий необходимо не только сушить. Для поддержания их в сухом состоянии приходится постоянно поддерживать разность потенциалов, препятствующую увлажнению стен капиллярной водой в течение всего времени дальнейшей эксплуатации здания.
Электрофорез Явление электрофореза, вызванное внешним электрическим полем, наблюдается, когда частицы дисперсной фазы могут свободно перемещаться в дисперсионной среде. Для изучения электрофореза используют высокодисперсные системы – золи. Явление электрофореза - подобно электролизу, с тем отличием, что в дисперсионной среде в движении участвуют не только ионы, но и заряженные частицы дисперсной фазы. Прибор, с помощью которого можно наблюдать электрофорез, представлен на рис. 26. С помощью кранов колена U-образной трубки соединены с золем той же электропроводности, что и электролит. Золь подают снизу через воронку при открытых кранах. После заполнения золем колен U-образной трубки кран у воронки закрывают и замыкают электрическую цепь. Наблюдают перемещение золя к тому электроду, который имеет знак, противоположный заряду частиц дисперсной фазы. Электрофорез широко применяется в исследовании биологических систем и в медицине (физиотерапия). С помощью электрофореза проводят разделение природных белков различной структуры, определяют степень чистоты антибиотиков и витаминов. Примером технического применения электрофореза может служить окраска кузовов автомобилей в электрическом поле высокого напряжения.
Рис. 26. Схема прибора для электрофореза: а) исходное состояние системы; при открытых кранах снизу через воронку заливают золь в колена U-образной трубки, содержащие раствор электролита; б) при закрытом кране у воронки включают источник постоянного тока и наблюдают явление электрофореза по изменению уровней золя в коленах.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 569; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.82.177 (0.013 с.) |




 [AgI] mn Ag+|(n - у)NO3 - | у NO3 -.
[AgI] mn Ag+|(n - у)NO3 - | у NO3 -.






 Потенцииалоопределяющими становятся ионы йода, и микрочастицы приобретают отрицательный заряд (рис. 21).
Потенцииалоопределяющими становятся ионы йода, и микрочастицы приобретают отрицательный заряд (рис. 21).





 [AgI] mn I - |(n K + + у Fe3+)| (n + 3 у NO3 -.
[AgI] mn I - |(n K + + у Fe3+)| (n + 3 у NO3 -.




 [SiO2] mn HSiO3 - |(n - у) H3O+ | у H3O+.
[SiO2] mn HSiO3 - |(n - у) H3O+ | у H3O+.




