
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы гетерогенных дисперсионных системСодержание книги
Поиск на нашем сайте
(классификация по агрегатным состояниям)
Таким образом, дисперсные системы – гетерогенные системы. В системах Ж-Г, Ж-Т, Г-Т и других каждая фаза ограничена внешней поверхностью. Состояние вещества у поверхности раздела соприкасающихся фаз отличается от его состояния внутри этих фаз. Это различие вызывает особые поверхностные явления на границе раздела фаз. Чем больше поверхность раздела между фазами (или поверхность единицы объема системы), тем больше ее избыточная свободная энергия, сконцентрированная на поверхности раздела фаз. Следовательно, все дисперсные и особенно коллоидные системы обладают большим запасом, или избытком, свободной энергии, сконцентрированным на поверхности дисперсной фазы, чем обычные массивные тела. Условием устойчивого равновесия системы является минимум свободной энергии. Системы с большим запасом свободной энергии неравновесны, термодинамически неустойчивы, в них будут самопроизвольно протекать процессы, сопровождающиеся уменьшением запаса свободной энергии, которая всегда стремится к минимальному значению. Одним из таких самопроизвольных процессов, протекающих на границе раздела двух фаз и приводящих к снижению поверхностного натяжения, является адсорбция. Изменение концентрации газообразного или растворенного вещества на границе раздела фаз – на поверхности твердого тела или жидкости – называется адсорбцией. Повышение концентрации на границе раздела фаз есть положительная адсорбция. Растворенные вещества, понижающие поверхностное натяжение растворителя, называются поверхностно-активными (ПАВ), а повышающие – поверхностно-инактивными. Одно и то же поверхностно-активное вещество может гидрофобную жидкость делать гидрофильной, а гидрофильную превращает в гидрофобную (рисунок).
а б Ориентация молекул поверхностно-активных веществ на границе: а – вода – масло; б – масло-вода
Вещество, поглощающее своей поверхностью молекулы или ионы других веществ, называется адсорбентом. Адсорбируемое вещество называется адсорбтивом: адсорбция адсорбент + адсорбтив адсорбат десорбция В некоторых случаях поглощение, начавшееся на поверхности, распространяется вглубь поглотителя. Такой процесс называется абсорбцией. Общий термин для всех явлений, связанных с поглощением – сорбция. Следовательно, адсорбция и абсорбция представляют собой частные случаи сорбции. Абсорбция – явление объемное, а адсорбция – чисто поверхностное. Сорбция может ограничиваться либо только взаимодействием за счет физических (ван-дер-ваальсовых) сил, либо одновременно сопровождается образованием нового вещества за счет проявления валентных (химических) сил (хемосорбция).
Лекция 11. Растворы электролитов. Электролитическая Диссоциация
По способности проводить электрический ток все вещества делятся на электролиты (проводящие электрический ток) и неэлектролиты (не проводящие электрический ток). Электролиты -вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относится большинство неорганических кислот, оснований и солей. В среде высокой диэлектрической проницаемости (спирты, вода и др.) они распадаются на ионы. Процесс распада молекул на ионы называется электролитической диссоциацией: NaCl Количественной характеристикой процесса диссоциации является степень диссоциации ( a ), которая показывает отношение числа молекул, распавшихся на ионы (Nион), к общему числу растворенных молекул (Nобщ): a= Nион / Nобщ. По степени диссоциации электролиты делятся: 1) на сильные, которые в 0,1 М растворе имеют a>30%; к ним относятся: почти все соли (кроме HgCl2, СdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторые другие); сильные минеральные кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4); основания щелочных (LiOH, NaOH, KOH, RbOH, CsOH, FrOH) и щелочно-земельных металлов(Ca(OH)2, Sr(OH)2, Ba(OH)2); 2) средние (a = 3 - 30 % в 0,1 М растворах); к ним относятся, например, H3PO4, H2SO3, HF, Mg(OH)2; 3) слабые (a < 3 % в 0,1 М растворах); слабыми электролитами являются H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HClO и др., а также большинство оснований многовалентных металлов, NH4OH и вода. Сильные электролиты практически нацело диссоциируют на ионы, и этот процесс можно изобразить следующим образом: HCl Для оценки состояния ионов в растворе пользуются активностью – условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе (См) соотношением: а = f·См, где f - коэффициент активности иона (безразмерная величина). Коэффициенты активности ионов зависят от состава и концентрации раствора, заряда и природы иона и других условий. Значения коэффициентов активности по рассчитанной ионной силе раствора можно определить с использованием соответствующих таблиц. Ионная сила раствора (Ι) равна полусумме произведений молярных концентрации (См) каждого иона на квадрат его заряда (Z): Ι = 0,5 (C1Z12 + C2Z22 + … + CnZn2) = 0,5 Σ Ci Zi 2, (i = от 1 до n) Слабые электролиты диссоциируют частично и обратимо. В их растворах преобладают не ионы, а молекулы. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать константу равновесия, которая называется константой диссоциации (КД) и приводится в таблицах. Константа диссоциации характеризует силу электролита: чем больше величина КД., тем сильнее электролит, и наоборот. HNO2
Равновесия в слабых электролитах подчиняются закону разведения Оствальда. Если общая молярная концентрация слабого электролита, например, слабой кислоты HNO2 равна С (моль/л), тогда концентрация ионов H+ и NO2- будет определяться выражением [H+] = [NO2-] = С·a (моль/л), а концентрация недиссоциированного электролита [HNO2] = (С-С·a). Тогда
Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов, температуры. Для одного и того же электролита при данной температуре степень диссоциации (a) увеличивается с разбавлением раствора; при больших разбавлениях электролит полностью диссоциирует (a®1). С увеличением температуры a также увеличивается. Лекция 12. Диссоциация воды. Диссоциация кислот и оснований. Водородный показатель
Вода в очень малой степени находится в диссоциированном состоянии (очень слабый электролит): H2O
При столь малой константе диссоциации (КД) концентрация воды остается практически неизменной и равной [H2O]=1000/18=55.6 моль/л. Произведение постоянных величин - также постоянная величина: Kд∙[H2O] = [H+]∙[OH–]. В соответствии с теорией электролитической диссоциации ионы H+ являются носителями кислотных свойств, а ионы OH– - носителями основных свойств. Поэтому раствор будет нейтральным, при условии: [H+] = [OH–] = 10–7 моль/л; при [H+] > [OH–] – кислым; при [H+] < [OH–] – щелочным. Концентрация катионов водорода [H+] обычно выражается очень малыми величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который назван водородным показателем, и обозначается рН: рН = –lg [H+], где [H+] - молярная концентрация ионов H+. Следовательно: [H+]= 10–pH Если реакция среды нейтральная, то [H+] = 10–7 [моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7 [моль/л], и рН<7. Если среда щелочная, то [H+]<10–7 [моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН): рОН = –lg [ОH- ], где [ОH- ] - молярная концентрация ионов ОH-. А также показатель константы воды: рКВ = –lg КВ. Логарифмируя ионное произведение воды, получаем выражение: –lg [H+][OH–] = –lg 10–14 и далее: pH + pOH = 14. Кислота (определение по Аррениусу) – это химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 343; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.131.115 (0.008 с.) |

 .
. 
 Na+ + Cl-. Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин «сольватация» заменяется термином «гидратация».
Na+ + Cl-. Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин «сольватация» заменяется термином «гидратация».
 1, где [H+], [NO2-], [HNO2] – молярные равновесные концентрации соответствующих частиц в растворе, КД– константа диссоциации азотистой кислоты HNO2
1, где [H+], [NO2-], [HNO2] – молярные равновесные концентрации соответствующих частиц в растворе, КД– константа диссоциации азотистой кислоты HNO2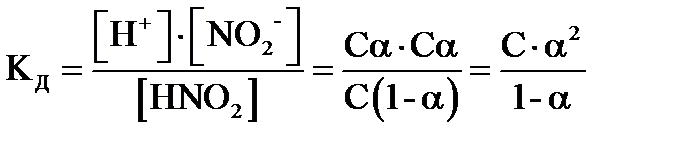 . При a << 1 получим КД = С.a2 и
. При a << 1 получим КД = С.a2 и  .
. H+ + OH –
H+ + OH –




