
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение коррозионно-стойких материалов.Содержание книги
Поиск на нашем сайте
3. Обработка коррозионной среды реагентами. В роли реагентов, замедляющих коррозию, выступают ингибиторы. В зависимости от природы металла и окружающей среды применяются различные ингибиторы. 4. Электрохимические методы защиты металлических изделий подразделяются на протекторную, катодную, электродренажную и анодную защиты. Протекторная защита заключается в присоединении к защищаемому сооружению более активного металла,который выполняет роль протектора и разрушается, а металлическая конструкция (катод) сохраняется. Протектор периодически возобновляется в связи с его растворением. При катодной защите защищаемая конструкция присоединяется к отрицательному полюсу источника электрического тока. При электродренажной защите блуждающие токи с защищаемого трубопровода отводятся с помощью электродренажной установки к рельсовой сети (источнику блуждающих токов). Смысл анодной защиты заключается в создании на поверхности защищаемой конструкции пассивирующей пленки с помощью анодной поляризации от внешнего источника постоянного тока, то есть переводом металла в устойчивое пассивное состояние.
Лекция 20. Металлы главной подгруппы II группы. Жесткость воды
В главную подгруппу II группы входят металлы бериллий Ве, магний Mg и щелочноземельные металлы кальций Са, стронций Sr, барий Ва. Электронное строение этих металлов:
12Mg 2s22p63s2 - радиус атомов увеличивается 20Ca …3s23p64s2 - прочность связи электрона внешнего 38Sr …4s24p65s2 слоя с ядром уменьшается 56Ba …5s25p66s2 - способность атомов к отдаче электрона (т.е. восстановительные св-ва) усиливаются Физические свойства. В свободном состоянии магний и щелочноземельные металлы представляют собой серебристо-белые вещества, более твердые, чем щелочные металлы. Нахождение в природе. Как и щелочные металлы, магний и щелочноземельные металлы в природе встречаются только в виде соединений. Их природные соединения: CaCO3∙MgCO3 –доломит; MgCO3 –магнезит; KCl∙MgCl2· 6Н2O – карналлит; MgSO4·7Н2O – горькая (английская) соль; CaCO3 - кальцит (известняк, мел, мрамор); СаF2 – флюорит; Ca3(PO4)2 – фосфорит; BaSO4 - барит.
2Са + O2 → 2СаO; 2Mg + O2 → 2MgO
Mg + Cl2 → MgCl2; Ca + H2 → CaH2; 3 Mg + N2 → Mg 3N2 Щелочноземельные металлы активно взаимодействуют с холодной водой, а магний реагирует только с кипящей водой: Са + 2Н2O → Са(OH)2 + Н2 ↑ Соединения s- металлов и их применение. Оксиды s-металлов – типичные основные оксиды. За исключением оксидов бериллия и магния оксиды, пероксиды остальных элементов легко реагируют с водой, образуя сильнощелочные растворы: BaO2 + 2H2O → Ba(OH)2 + H2O2 CaO – негашеная известь. Негашеная жженая известь применяется в строительстве: приготовление известкового раствора, исходный продукт для получения СаС2 и NН3, используется в качестве добавки в процессе переработки руды, компонент цемента, удобрение. CaO + H2O → Са(ОН)2 + 65 кДж (гашение извести). Сульфат кальция - CaSO4 – применяется при производстве алебастра, состоящего из CaSO4 · 0,5H2O и высокодисперсного CaSO4. Его получают частичным обезвоживанием (при 160ºС) гипса CaSO4·2H2О. При добавлении воды к алебастру снова образуется CaSO4·2Н2O, кристаллы которого переплетаются, образуя прочную массу: CaSO4·0,5Н2О + 1,5Н2O → CaSO4 · 2H2O На этом свойстве основано использование алебастра в строительстве, а также в медицинской практике для накладывания гипсовых повязок. Растворимые соли кальция и магния (CaSO4, MgCl2, MgSO4, CaSO4, Са(НСО3)2 и т.д.) обусловливает жесткость воды, которая выражается в мг-экв/л. Вода с жесткостью меньше 4 мг-экв/л считается мягкой, а выше 12 мг-экв/л - очень жесткой. Различают временную и постоянную жесткость воды. Гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат магния - Mg(НСO3)2 обуславливают временную (карбонатную) жесткость воды. Образование гидрокарбоната кальция в природных условиях имеет место, когда породы, содержащие СаСО3, подвергаются воздействию воды и растворенного в ней углекислого газа СO2:
Удалить временную жесткость воды можно несколькими способами: 1) кипячение: Са(НСO3)2 → CaCO3 + CO2↑ + H2O; 2) известковый способ: Са(ОН)2 + Mg(НСО3)2 → MgCO3 + CaCO3; 3) содовый способ: Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaHCO3; 4) щелочной способ: Ca(HCO3)2+2NaOH → CaCO3+Na2CO3+2H2O. Растворимые кальциевые и магниевые соли сильных кислот обусловливают некарбонатную или постоянную жесткость. Методы устранения постоянной жесткости: CaSO4 + Na2CO3 = CaCО3↓ +Na2 SO4; CaCl2 + Na2CO3 = CaCО3↓+ 2NaCl MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl; MgSO4 + Ca(OH)2 = Mg(ОH)2↓ + CaSO4 MgCl2 + Ca(OH)2= Mg(OH)2↓ + CaCl2 MgSO4 + 2NaOH = Mg(OH)2↓ + 2Na2SO4 Лекция 21. Конструкционные металлы. Алюминий. Хром. Железо
Алюминий – основной представитель металлов главной подгруппы III группы периодической системы. Внешняя электронная конфигурация - 3s23p1, в соединениях проявляет степень окисления +3. Нахождение в природе. По распространенности занимает третье место среди всех элементов (после О и Si) и первое среди металлов. Важнейшие минералы: бокситы – смесь гидроксидов Al(OH)3 и AlOOH; алюмосиликаты – (Na,K)2O∙Al2O3∙2SiO2; корунд (глинозем) – Al2O3; криолит – 3NaF∙AlF3. Физические свойства. Серебристо-белый металл, плотность (при 20°С) 2698,9 кг/м3; tпл 660,24°С; tкип около 2500°С; Химические свойства. Алюминий является активным металлом, сильным восстановителем. Но наличие защитной оксидной пленки на его поверхности затрудняет его взаимодействие со многими окислителями при обычных условиях. При 25ºС алюминий образует с хлором, бромом и иодом соответственно AlCl3, AlВr3, AlI3. Реакции с фтором, кислородом, азотом, серой происходят при достаточно высоких температурах. В отличие от щелочных и щелочноземельных металлов, алюминий при обычных условиях не реагирует с водой, так как защищен пленкой нерастворимого в воде оксида. Однако эта пленка легко растворяется в растворах кислот и щелочей, поэтому не защищает алюминий от взаимодействия с ними: 2Al + 6HCl → 2AlCl3 + 3H2↑ Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Исключением являются концентрированные серная и азотная кислоты, в которых алюминий пассивируется. Важным свойством алюминия является его способность восстанавливать некоторые металлы из их оксидов при высокой температуре. Этот способ получения металлов называется алюмотермией: 4Al + 3MnO2 → 3Mn + 2Al2O3 Хром. Внешняя электронная конфигурация атома хрома 3d54s1. В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Сr3+. Нахождение в природе. Хром – довольно распространенный элемент на Земле. Его кларк (среднее содержание в земной коре) составляет 8,3·10–3%. Хром никогда не встречается в свободном состоянии. В хромовых рудах практическое значение имеет только хромит FeCr2O4. Физические свойства. Хром - твердый, тяжелый, тугоплавкий металл. Плотность 7190 кг/м3; tпл 1890 °С; tкип 2480 °С. Химические свойства. Хром химически малоактивен. При обычных условиях устойчив к кислороду и влаге, но соединяется с фтором, образуя CrF3. Выше 600°С взаимодействует с парами воды, давая Сr2О3; с азотом - Cr2N, CrN; с углеродом - Сr3С2; с серой - Cr2S3. Со многими металлами хром дает сплавы. Хром загорается в кислороде при 2000°С с образованием темно-зеленого оксида хрома (III) Сr2О3. Помимо оксида (III), известны других соединения с кислородом, например CrO, СrО3, получаемые косвенным путем. Хром легко реагирует с разбавленными растворами соляной и серной кислот с образованием хлорида и сульфата хрома и выделением водорода; «царская водка» и азотная кислота пассивируют хром. С увеличением степени окисления возрастают кислотные и окислительные свойства хрома.
Железо. Конфигурация внешней электронной оболочки атома 3d64s2. Железо проявляет переменную валентность (наиболее устойчивые степени окисления +2 и +3). Нахождение в природе. По распространенности в земной коре занимает второе место среди металлов. Для извлечения железа используются в основном такие руды, как гематит (Fe2O3), магнитные железняки (Fe3О4), бурые железняки (НFeO2· nH2O), а также шпатовые железняки (FeСО3). Физические свойства. Плотность (20°C) 7874 кг/м3, tпл 1539°С, tкип 3200°С. Химические свойства. С кислородом железо образует оксид (II) FeO, оксид (III) Fe2O3 и оксид (II,III) Fe3O4 (соединение FeO c Fe2O3, имеющее структуру шпинели). Во влажном воздухе при обычной температуре железо покрывается рыхлой ржавчиной (Fe2O3·nH2O). Вследствие своей пористости ржавчина не препятствует доступу кислорода и влаги к металлу и поэтому не предохраняет его от дальнейшего окисления. При нагревании в водяном паре железо окисляется с образованием Fe3O4 (ниже 570 °С) или FeO (выше 570 °С) и выделением водорода. Железо легко реагирует с галогенами и галогеноводородами, давая соли, например хлориды FeCl2 и FeCl3. При нагревании железа с серой образуются сульфиды FeS и FeS2. Карбиды железа - Fe3C (цементит) и Fe2C (е-карбид) - выпадают из твердых растворов углерода в железе при охлаждении. Fe3C выделяется также из растворов углерода в жидком железе при высоких концентрациях С. При нагревании железо энергично реагирует с кремнием и фосфором, образуя силициды (например, Fe3Si и фосфиды (например, Fe3P).
Лекция 22. Полимеры
Высокомолекулярными соединениями (ВМС), или полимерами, называют сложные вещества сбольшими молекулярными массами (порядка сотен, тысяч и миллионов), молекулы которых построены из множества повторяющихся элементарных звеньев, образующихся в результате взаимодействия и соединения друг с другом одинаковых или разных простых молекул – мономеров. Классификация полимеров: I. По методам получения выделяют природные – ВМС растительного и природного происхождения (крахмал, целлюлоза, белки, природные каучуки) и химические: 1) искусственные ВМС – получают путем переработки природных ВМС (эфиры целлюлозы и т.д.); 2) с интетические ВМС – получают путем синтеза из низкомолекулярных веществ (полиэтилен, полистирол, синтетические каучуки, лавсан, капрон, нитрон).
Получение полимеров из низкомолекулярных веществ может быть осуществлено двумя путями: 1. Реакция полимеризации — процесс, в результате которого молекулы низкомолекулярного соединения (мономера) соединяются друг с другом при помощи ковалентных связей, образуя новое вещество (полимер), молекулярная масса которого в целое число раз больше, чем у мономера; полимеризация характерна, главным образом, для соединений с кратными (двойными или тройными) связями, например для этилена:
Полимеризацией также получают полипропилен, бутадиеновый каучук, полистирол, тефлон, полиметилметакрилат. 2. Реакция поликонденсации — процесс образования полимера из низкомолекулярных соединений, содержащих две или несколько функциональных групп, сопровождающийся выделением за счет этих групп таких веществ, как вода, аммиак, галогеноводород и т. п.; состав элементарного звена полимера в этом случае отличается от состава исходного мономера. Поликонденсацией получают фенолоформальдегидные смолы (ФФС) из формальдегида и фенола. Процесс сопровождается выделением воды:
Частным случаем полимеризации является сополимеризация – процесс образования полимеров из двух или нескольких различных мономеров. Например, получение бутадиен-стирольного каучука:
II. По свойствам и применению выделяют следующие полимеры: 1. Пластмассы (термореактивные и термопластичные):
2. Эластомеры (каучуки, резина) Каучуки – природные или синтетические продукты полимеризации некоторых диеновых углеводородов с сопряженными связями:
Резины – эластичные материалы, получаемые вулканизацией каучука (взаимодействием каучуков с серой, при котором происходит сшивание молекул каучука в единую пространственную сетку):
В зависимости от количества серы (по масс.) выделяют мягкие резины (5-10% S) и твердые резины (>30% S). Лекция 23. Химическая идентификация, анализ вещества
Химическая идентификация – это установление вида и состояния фаз, молекул, атомов, ионов и других составных частей вещества на основе сопоставления экспериментальных и соответствующих справочных данных для известных веществ. Идентификация – цель качественного анализа вещества, при котором определяют, из каких атомов, ионов, молекул состоит вещество. Количественный анализ – определение содержания (концентрации, массы и т.п.) компонентов в анализируемом веществе. Все методы анализа можно разделить на химические, физико-химические, физические и биологические, в которых измеряют соответственно химические, физико-химические, физические и биологические параметры анализируемого вещества, которые зависят от его состава. При химических методах открываемый элемент переводят в какое-либо новое соединение, обладающее характерным свойством (аналитический сигнал). Происходящее при этом химическое превращение называется аналитической реакцией.
Любой катион можно идентифицировать с помощью какой-либо реакции, если удалить другие катионы, мешающие этой реакции. Существуют некоторые реакции, которые позволяют обнаружить то или иное вещество (ион) в присутствии других веществ, такие реакции называют специфическими. Так, катион NH4+ можно обнаружить в присутствии любых других действием щелочи на анализируемое вещество по характерному запаху аммиака. NH4Cl + NaOH → NH3↑ + H2O + NaCl Анион CO32- - при воздействии кислотой, при этом протекает реакция с образованием пузырьков диоксида углерода. CO32- + 2H+ → H2CO3 Применяя специфические реакции, открывают соответствующие ионы дробным методом, т.е. непосредственно в отдельных порциях исследуемого раствора. Если открытие ионов дробным методом невозможно, используют систематический анализ, при котором ионы выделяют из сложной смеси группами. Для этого используют групповые реагенты. Групповым реагентом для ионов Ag+, Pb2+, Hg2+ является HCl, для ионов Ba2+, Sr2+, Ca2+ - (NH4)2CO3 и т.д. Если присутствует несколько катионов, используют дробный анализ, в ходе которого осаждают все труднорастворимые соединения, а затем обнаруживают оставшиеся катионы с помощью специфических реакций. Химические методы количественного анализа делят на гравиметрический и объемный (титриметрический). Так, определить содержание Ca2+ в анализируемом веществе можно воздействием на него щавелевой кислоты. Ca2+ + H2C2O4 → CaC2O4 + 2H+ По массе образующегося осадка определяют содержание Ca2+ в анализируемом веществе (гравиметрический метод). Сущность титриметрического метода заключается в измерении объема рабочего раствора с точно известной концентрацией того или иного реагента, израсходованного на реакцию с анализируемым компонентом. Методы объемного химического анализа подразделяются по типу реакции, лежащей в основе анализа: метод кислотно-основного титрования (нейтрализации), методы осаждения и комплексообразования, метод окисления – восстановления. Метод нейтрализации основан на реакции H+ + OH- → H2O. При комплексонометрическом титровании происходит связывание исследуемого иона в комплекс. В основе окислительно-восстановительного титрования лежит реакция Ox + ne Физико-химические методы анализа основаны на изучении физических свойств веществ, меняющихся в ходе химической реакции. При потенциометрическом методе измеряется потенциал электрода в исследуемом растворе, при кондуктометрическом – электрическая проводимость и т. д. Физические методы анализа основаны на использовании зависимости между физическим свойством и составом вещества. К ним относят спектральные, люминесцентный метод и т. д. Биологические методы основаны на изучении зависимости отклика микроорганизмов на то или иное вещество.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 644; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.3.198 (0.008 с.) |








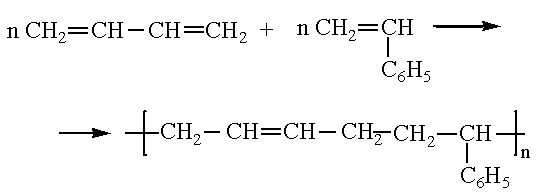

 H2O + CO2↑
H2O + CO2↑


