Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства дисперсных систем разных типовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
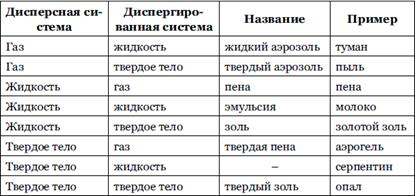
. По агрегатному состоянию ДФ и ДС
3. По интенсивности межмолекулярных взаимодействий между дисперсной фазой и дисперсионной средой (пригодно только для систем с жидкой дисперсионной средой - лиофильные системы (гидрофильные, если дисперсионная среда – вода) Такие системы характеризуются сильным взаимодействием частиц ДФ с ДС (вплоть до растворения). Они образуются самопроизвольно, термодинамически агрегативно устойчивы, имеют низкие значения поверхностной энергии, вследствие наличия сольватных (гидратных) оболочек из молекул ДС вокруг частиц ДФ. Это мицеллярные растворы ПАВ, критические эмульсии, растворы некоторых природных ВМС, например, белков, крахмала, целлюлозы. - лиофобные (гидрофобные) системы Это системы, частицы дисперсной фазы которых слабо взаимодействуют с дисперсионной средой. Они могут образовываться как из органических, так и неорганических веществ, нерастворимых в данной дисперсионной среде. Они образуются не самопроизвольно, а путем принудительного диспергирования и конденсации. Термодинамически агрегативно неустойчивы вследствие избытка энергии на МФП. К ним относятся золи, суспензии, эмульсии. 4. По наличию или отсутствию взаимодействия между частицами дисперсной фазы - свободнодисперсные системы К таким системам относятся бесструктурные системы, в которых частицы дисперсной фазы не связаны друг с другом в одну сплошную сетку или каркас и способны независимо перемещаться в дисперсионной среде под влиянием броуновского движения или силы тяжести. К подобным системам относят достаточно разбавленные суспензии и эмульсии, аэрозоли, лиозоли. - связнодисперсные системы В таких системах частицы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Примерами этих систем являются гели, концентрированные суспензии (пасты) и эмульсии, пены, порошки. До сих пор дисперсную систему мы рассматривали как совокупность частиц дисперсной фазы и окружающей их сплошной дисперсионной среды. Вместе с тем в связнодисперсных системах обе фазы могут быть непрерывными, пронизывая друг друга; такие системы называются биконтинуальными. Таковы пористые твердые тела с открытой пористостью (сорбенты, катализаторы), грунты, многие породы, в том числе нефтеносные. Методы получения коллоидных растворов Коллоидные растворы могут быть получены: 1. Дисперсионными методами, основанными на дроблении, или диспергировании крупных частиц вещества до коллоидных размеров. Диспергирование можно проводить механическим измельчением, электрическим распылением и так далее. К дисперсным методам относятся – процесс образования золей из гелей или рыхлых осадков при действии на них пептизаторов (в большинстве случаев электролитов), адсорбирующихся на поверхности коллоидных ядер и способствующих их взаимодействию с дисперсионной средой. 2. Конденсационными методами, основанными на агрегации молекул или ионов более крупные частицы. Агрегацию частиц можно осуществлять различными способами. Так, для получения золей гидроксидов металлов чаще всего пользуются методом гидролиза. Например, золь гидроксида железа (III) легко образуется, когда раствор хлорида железа (III) приливают в кипящую воду. Объясняется это тем, что холодный раствор содержит слабо диссоциированные продукты неполного гидролиза трехвалентного железа,, которые при разбавлении в кипящей воде гидролизируются полностью с образованием гидроксида железа (III).
Очистка золей Для очистки золей от примесей нежелательных низкомолекулярных соединений применяют диализ или ультрафильтрацию. Диализ основан на способности молекул или ионов малых размеров проходить через полупроницаемые пленки или мембраны, тогда как крупные частицы дисперсной фазы такой способностью не обладают.Полупроницаемыми являются различные растительные, животные и искусственные мембраны. Их можно приготовить из пергамента, бычьего, свиного, рыбьего пузыря, коллодия, целлофана и т.д.Приборы, в которых осуществляется диализ, называются диализаторами.За счет диффузии низкомолекулярные примеси постепенно переходят через мембрану из золя во внешний сосуд с растворителем.Недостатком данного метода является большая длительность процесса очистки.Если в качестве низкомолекулярных примесей выступают электролиты, то скорость очистки можно существенно увеличить используя для этого постоянный электрический ток. Такой процесс называется электродиализом. Более универсальным методом очистки золей является ультрафильтрация, когда удаление примесей осуществляется через специально приготовленные плотные фильтры или мембраны, непроницаемые для коллоидных частиц.Для ускорения процесса очистки ультрафильтрацию проводят при перепаде давления по обе стороны фильтра: под разряжением (вакуумом) или под повышенным давлением. Вакуум создают откачиванием воздуха из расположенного под фильтром сосуда (рис. 53); повышенное давление – нагнетанием воздуха в сосуд, расположенный над фильтром (рис. 54). Ультрафильтрацию используют не только для очистки золей, но и для образования их концентрированных растворов из разбавленных 31. Молекулярно-кинетические свойства коллоидных систем. Броуновское движение. Диффузия. Осмотическое давление. Седиментационное равновесие. Молекулярно-кинетическими называют свойства, обусловленные хаотическим тепловым движением частиц, образующих те или иные системы. К молекулярно-кинетическим свойствам дисперсных систем относятся броуновское движение, диффузия, осмос и седиментация. Броуновское движение – это беспорядочное движение коллоидных частиц. Впервые обнаружено в 1827 г. шотландским ботаником Р.Броуном, наблюдавшим под микроскопом непрерывные колебательные движения пыльцы растений в её взвеси в воде. Причиной этого видимого движения является непрерывное, невидимое даже в микроскоп, хаотическое тепловое движение молекул дисперсионной среды, непрерывно сталкивающихся с коллоидными частицами. Интенсивность броуновского движения тем больше, чем менее скомпенсированы удары, которые получает одновременно частица со стороны молекул среды; она возрастает с повышением температуры, уменьшением размеров частиц и вязкости среды. (Для частиц крупнее 1-3 мкм броуновское движение прекращается.) Для коллоидных частиц, обладающих тепловым движением, присущи также явления диффузии и осмоса. Диффузия – это самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации. Скорость диффузии при постоянных температуре и вязкости среды зависит от величины и формы частиц. Осмос – это односторонняя диффузия вещества через полупроницаемую мембрану. Характерным признаком, отличающим коллоидные системы от истинных растворов низкомолекулярных веществ, является очень медленная скорость диффузии и низкое осмотическое давление. Кроме этого, в коллоидных системах, вопреки диффузии и тепловому движению, наблюдается своеобразное распределение коллоидных частиц по высоте. В нижних слоях раствора концентрация дисперсных частиц может быть существенно выше, чем в верхних. Связано это с их перемещением под действием гравитационного поля. Наиболее заметно это явление имеет место в грубодисперсных системах и наблюдается даже в небольших объёмах в виде осаждения (седиментации) относительно более крупных и тяжёлых частиц под действием силы тяжести. Такие системы кинетически (седиментационно) неустойчивы. В истинных растворах низкомолекулярных веществ седиментация совершенно ничтожна и проявляется только в очень больших объёмах, например, изменение атмосферного давления с высотой. Коллоидные системы (золи) занимают в этом ряду промежуточное положение, но, так как размеры коллоидных частиц очень малы, то коллоидные системы, также как истинные растворы, являются кинетически (седиментационно) устойчивыми, т.е. в них не происходит осаждения дисперсной фазы. Но с течением времени в зависимости от соотношения плотностей частиц дисперсной фазы и дисперсионной среды коллоидные частицы определённым образом распределяются в объёме дисперсионной среды, и при неизменных внешних условиях такое распределение сохраняется постоянным: более тяжёлые частицы оказываются в нижней части сосуда, более лёгкие концентрируются в верхних слоях. Такое распределение частиц называется перреновским седиментационным равновесием. С едимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил. Скорость седиментации зависит от массы, размера, формы и плотности вещества частицы, вязкости и плотности среды, а также от ускорения, силы тяжести и действующих на частицы центробежных сил. В поле гравитационных сил седиментируют частицы грубодисперсных систем; в поле центробежных сил возможна седиментация коллоидных частиц и макромолекул (см. центрифугирование). Седиментацию используют в промышленности при обогащении полезных ископаемых, различных продуктов химической и нефтехимической технологии, при водоочистке и др. Седиментация в центрифугах и ультрацентрифугах, а также в гравитационном поле лежит в основе седиментационного анализа.
32. Оптические свойства коллоидных растворов. Опалесценция, окраска. птические свойства коллоидных растворов: Размер частиц коллоидных растворов соизмерим с длиной волны. При попадании потока частиц на частицу будет наблюдаться дифракция (огибание). 1. Опалесценция 2. Эффект Тиндаля (Фарадея-Тиндаля) 3. Окраска золей Опалесценция - это визуально воспринимается, как самосвечение раствора (бело-голубого цвета) Наблюдается в неокрашенных коллоидных растворах. Опалесценция является следствием рассеяния света вследствие его дифракции в микроне однородной дисперсной системы. Светорассеяние коллоидных растворов является их характерным свойством, позволяющим отличать их от молекулярных и ионных растворов, поскольку с опалесценцией связано явление, специфическое для коллоидных систем – конус Тиндаля. Яркий свет от сильного источника направляется на сосуд с раствором. При наблюдении сбоку в случае коллоидного раствора наблюдается равномерное свечение освещенного участка, иногда с небольшим расширением на выходе. Рассеяние и поглощение света. Уравнение Релея. Окраска золей. Ультрамикроскопия и электронная микроскопия коллоидных систем. Определение формы, размеров и мицеллярной массы коллоидных частиц. Теория светорассеивания была разработана Д. Релеем. Интенсивность рассеянного света зависит от показателя преломления дисперсной фазы и дисперсионной среды, длины волны падающего света, поляризуемости частицы, зависящей от размера частиц, а также от частичной концентрации и интенсивности падающего света. Чем меньше длина волны падающего света, тем больше он рассеивается. Закон Релея объясняет различную окраску бесцветных золей в проходящем свете.
33. Электрические свойства коллоидных систем. Электрофорез и электроосмос. Двойной электрический слой. Электрокинетический потенциал.
В дисперсных системах на поверхности частиц (на границе раздела частица-дисперсионная среда) возникает двойной электрический слой (ДЭС). Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Поверхность частицы приобретает слой ионов определенного знака, равномерно распределенный по поверхности и создающий на ней поверхностный заряд. Эти ионы называют потенциалопределяющими (ПОИ). К поверхности частицы из жидкой среды притягиваются ионы противоположного знака, их называют противоионами (ПИ). Таким образом, двойной электрический слой состоит из потенциалопределяющих ионов и слоя противоионов, расположенных в дисперсионной среде. Слой противоионов состоит из двух слоев: · Адсорбционный слой (плотный слой), примыкающий непосредственно к межфазной поверхности. Данный слой формируется в результате электростатического взаимодействия с потенциалопределяющими ионами и специфической адсорбции. · Диффузный слой, в котором находятся противоионы. Эти противоионы притягиваются к частице за счет электростатических сил. Толщина диффузного слоя зависит от свойств системы и может достигать больших значений. При движении частицы двойной электрический слой разрывается. Место разрыва при перемещении твердой и жидкой фаз друг относительно друга называется плоскостью скольжения. Плоскость скольжения лежит на границе между диффузными и адсорбционными слоями, либо в диффузном слое вблизи этой границы. Потенциал на плоскости скольжения называют электрокинетическим или дзета-потенциалом (ζ -потенциал).
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1062; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |